

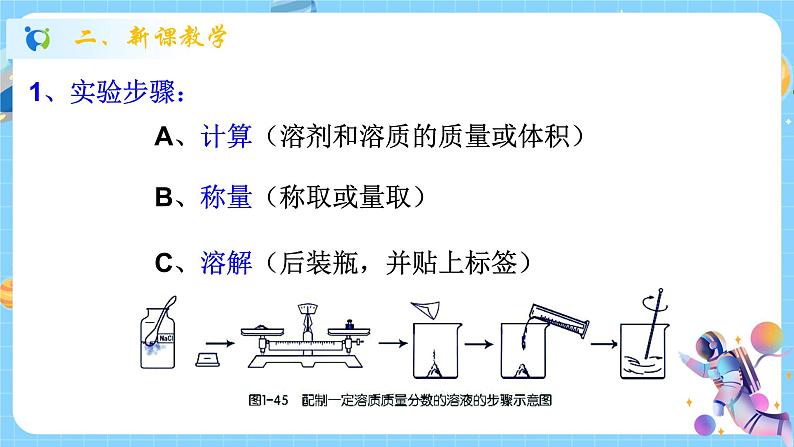

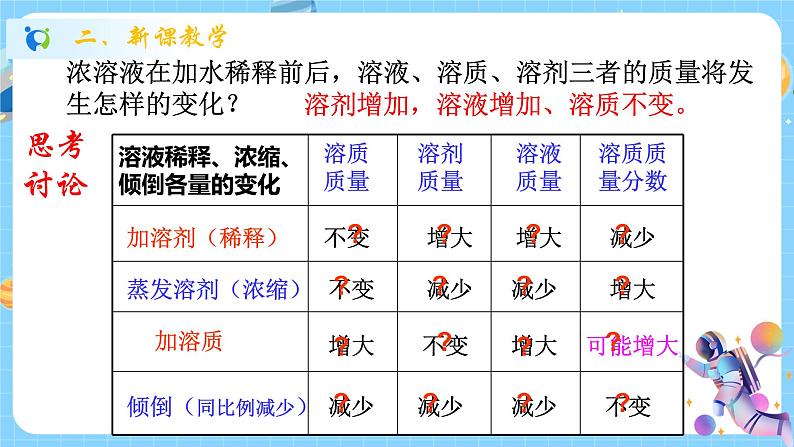




浙教版八年级上册第5节 物质的溶解课堂教学课件ppt
展开物质的溶解——溶液的配置
1.下列对“10%氯化钠溶液”含义的解释,错误的是( )。
A.100g水中溶解了10g氯化钠
B.将氯化钠与水按1∶9的质量比配成的溶液
C.将10g氯化钠溶于90g水中所得到的溶液
D.100g氯化钠溶液中溶解了10g氯化钠
2.关于溶液中溶质的质量分数,下列说法正确的是( )。
A.从溶质质量分数为20%的100g氯化钠溶液中取出10g溶液,则取出的溶液中溶质的质量分数为2%
B.100g氯化钠溶液中含有15g氯化钠,再往其中加入1g氯化钠,并使其完全溶解,则溶质的质量分数变为16%
C.400g甘油溶解在100g水中,所得甘油溶液中,溶质的质量分数为80%
D.在100g水中溶解20g氯化钠,所得溶液中,溶质的质量分数为20%
3.盐酸是氯化氢(HCl)气体的水溶液,是一种常用的酸。如图所示为某市售盐酸标签的部分内容,其中36.0%~38.0%表示( )。
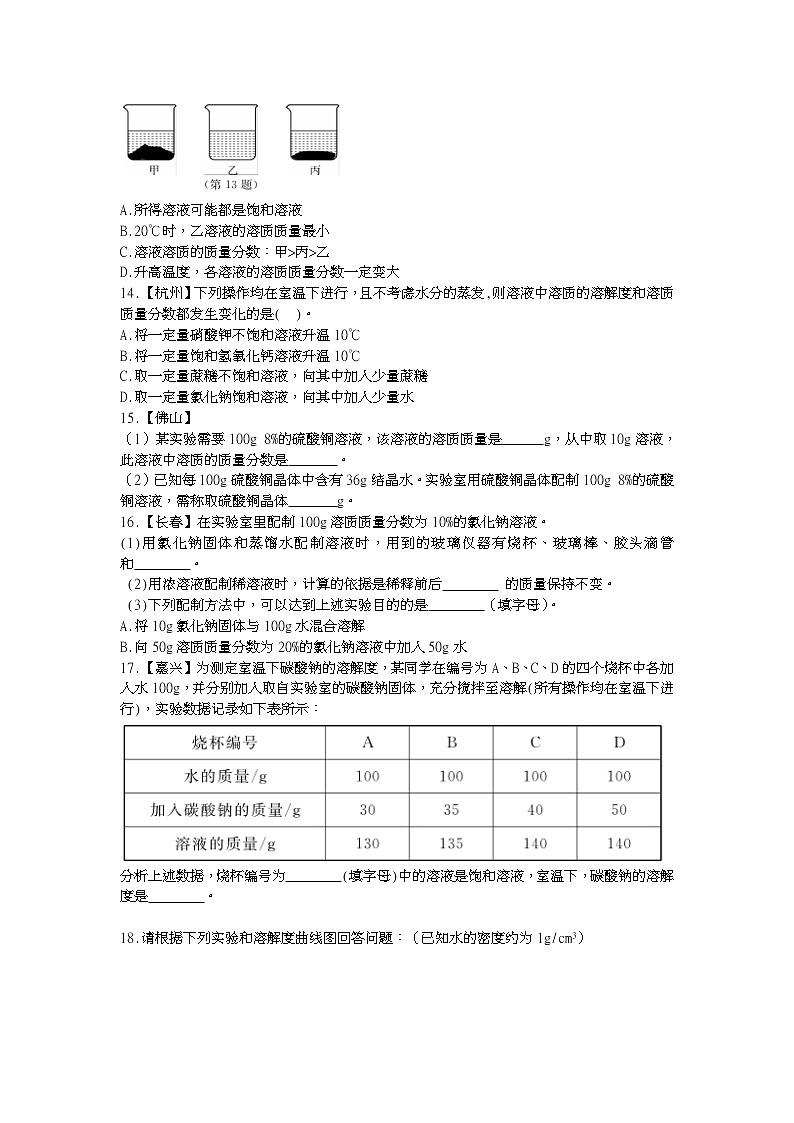
(第3题)
A.该盐酸中氯元素的含量 B.氯化氢气体在水中的溶解度
C.该瓶盐酸中溶质的质量 D.该盐酸的溶质质量分数
4.用氯化钠固体配制一定溶质质量分数的氯化钠溶液,必须使用的一组仪器是( )。
A.天平、烧杯、量筒、玻璃棒、药匙
B.天平、烧杯、量筒、铁架台、试管
C.天平、试管、漏斗、蒸发皿、玻璃棒
D.天平、集气瓶、漏斗、蒸发皿、玻璃棒
5.用氯化钠配制100g溶质质量分数为20%的氯化钠溶液,现有下列操作:①溶解;②称取氯化钠;③过滤;④量取水;⑤计算;⑥蒸发结晶。针对该实验,下列说法正确的是( )。
A.正确的操作顺序是⑤②④①③
B.直接在量筒中配制溶液,可以减小误差
C.配制时用量筒量取80mL蒸馏水
D.室温下,氯化钠的溶解度为25g
6.配制100g溶质质量分数为25.5%的硝酸钾溶液。下列操作中,会引起溶质质量分数偏低的是( )。
A.用托盘天平称量25.5g硝酸钾时,误将砝码放在左盘(注:砝码最小值为1g,1g以下用游码)
B.用量筒量取水时,俯视凹液面的最低处读数
C.将量筒中的水倒入烧杯时,有少量水溅出
D.将配制好的溶液转移到细口瓶时,不慎有少量洒落瓶外
7.【广东】如图所示为实验室中配制一定溶质质量分数的氯化钠溶液的流程图。
(第7题)
请回答下列问题:
(1)应称量 g氯化钠,需加水 mL。
(2)若称量氯化钠固体时指针向右偏转,则应 直到天平平衡。
(3)取上述溶液10g加水稀释到 g,可得到5%的氯化钠溶液。
8.实验室用密度为1.84g/mL、溶质质量分数为98%的浓硫酸和蒸馏水,配制500g溶质质量分数为20%的稀硫酸,则需要取的浓硫酸的体积与所用的量筒的量程分别为( )。
A.54.35mL、100mL B.55.5mL、100mL
C.54.35mL、250mL D.55.5mL、250mL
9.用25%的氢氧化钠溶液和5%的氢氧化钠溶液混合,配制10%的氢氧化钠溶液,则混合时两者的质量比为( )。
A.3∶1 B.1∶3C.1∶5D.5∶1
10.下表是硝酸钾在某些温度下的溶解度,将60℃时100g 24%的硝酸钾溶液恰好变成饱和溶液可以采用的方法是:加入硝酸钾 g;或降低温度到 ℃。
(第11题)
11.如图所示,甲表示溶质质量分数为20%的酒精溶液,乙表示溶质质量分数为55%的酒精溶液。
(1)将两者混合,所得溶液的溶质质量分数在 (填“Ⅰ”“Ⅱ”或“Ⅲ”,下同)区域。
(2)向20%的酒精溶液中加入水,所得溶液的溶质质量分数在 区域。
(3)向55%的酒精溶液中加入酒精,所得溶液的溶质质量分数在 区域。
12.某同学在实验室进行有关浓硫酸的实验时,观察到瓶上的标签如右表所示。他从瓶中倒出100mL浓硫酸用于配制稀硫酸。问:
(1)这100mL浓硫酸的质量是多少克?其中含溶质硫酸多少克?
(2)若将这100mL浓硫酸与500mL水均匀混合,则所得稀硫酸的质量分数是多少?
(3)欲配制1000g溶质质量分数为19.6%的稀硫酸,需要多少毫升这种浓硫酸和多少克水?
13.【金华】20℃时,在各自盛有100g水的三个烧杯中分别加入10g甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图所示。下列说法中,正确的是( )。
A.所得溶液可能都是饱和溶液
B.20℃时,乙溶液的溶质质量最小
C.溶液溶质的质量分数:甲>丙>乙
D.升高温度,各溶液的溶质质量分数一定变大
14.【杭州】下列操作均在室温下进行,且不考虑水分的蒸发,则溶液中溶质的溶解度和溶质质量分数都发生变化的是( )。
A.将一定量硝酸钾不饱和溶液升温10℃
B.将一定量饱和氢氧化钙溶液升温10℃
C.取一定量蔗糖不饱和溶液,向其中加入少量蔗糖
D.取一定量氯化钠饱和溶液,向其中加入少量水
15.【佛山】
(1)某实验需要100g 8%的硫酸铜溶液,该溶液的溶质质量是 g,从中取10g溶液, 此溶液中溶质的质量分数是 。
(2)已知每100g硫酸铜晶体中含有36g结晶水。实验室用硫酸铜晶体配制100g 8%的硫酸铜溶液,需称取硫酸铜晶体 g。
16.【长春】在实验室里配制100g溶质质量分数为10%的氯化钠溶液。
(1)用氯化钠固体和蒸馏水配制溶液时,用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
(2)用浓溶液配制稀溶液时,计算的依据是稀释前后 的质量保持不变。
(3)下列配制方法中,可以达到上述实验目的的是 (填字母)。
A.将10g氯化钠固体与100g水混合溶解
B.向50g溶质质量分数为20%的氯化钠溶液中加入50g水
17.【嘉兴】为测定室温下碳酸钠的溶解度,某同学在编号为A、B、C、D的四个烧杯中各加入水100g,并分别加入取自实验室的碳酸钠固体,充分搅拌至溶解(所有操作均在室温下进行),实验数据记录如下表所示:
分析上述数据,烧杯编号为 (填字母)中的溶液是饱和溶液,室温下,碳酸钠的溶解度是 。
18.请根据下列实验和溶解度曲线图回答问题:(已知水的密度约为1g/cm3)
(1)溶液③的质量为 g。溶液①~⑤中,一定属于不饱和溶液的是 (填序号,下同);溶质的质量分数一定相等的是 。
(第18题)
(2)析出晶体的质量为 。
(3)如图乙所示,M物质的溶液分别处于a、b、c、d四个点时,溶液中M的质量分数大小关系正确的是 (填字母)。
A.c>d=b>a B.c=d>a=b
C.c>a>b=d D.c>a=b>d
答案:
1.下列对“10%氯化钠溶液”含义的解释,错误的是(A)。
A.100g水中溶解了10g氯化钠
B.将氯化钠与水按1∶9的质量比配成的溶液
C.将10g氯化钠溶于90g水中所得到的溶液
D.100g氯化钠溶液中溶解了10g氯化钠
2.关于溶液中溶质的质量分数,下列说法正确的是(C)。
A.从溶质质量分数为20%的100g氯化钠溶液中取出10g溶液,则取出的溶液中溶质的质量分数为2%
B.100g氯化钠溶液中含有15g氯化钠,再往其中加入1g氯化钠,并使其完全溶解,则溶质的质量分数变为16%
C.400g甘油溶解在100g水中,所得甘油溶液中,溶质的质量分数为80%
D.在100g水中溶解20g氯化钠,所得溶液中,溶质的质量分数为20%
3.盐酸是氯化氢(HCl)气体的水溶液,是一种常用的酸。如图所示为某市售盐酸标签的部分内容,其中36.0%~38.0%表示(D)。
(第3题)
A.该盐酸中氯元素的含量 B.氯化氢气体在水中的溶解度
C.该瓶盐酸中溶质的质量 D.该盐酸的溶质质量分数
4.用氯化钠固体配制一定溶质质量分数的氯化钠溶液,必须使用的一组仪器是(A)。
A.天平、烧杯、量筒、玻璃棒、药匙
B.天平、烧杯、量筒、铁架台、试管
C.天平、试管、漏斗、蒸发皿、玻璃棒
D.天平、集气瓶、漏斗、蒸发皿、玻璃棒
5.用氯化钠配制100g溶质质量分数为20%的氯化钠溶液,现有下列操作:①溶解;②称取氯化钠;③过滤;④量取水;⑤计算;⑥蒸发结晶。针对该实验,下列说法正确的是(C)。
A.正确的操作顺序是⑤②④①③
B.直接在量筒中配制溶液,可以减小误差
C.配制时用量筒量取80mL蒸馏水
D.室温下,氯化钠的溶解度为25g
6.配制100g溶质质量分数为25.5%的硝酸钾溶液。下列操作中,会引起溶质质量分数偏低的是(A)。
A.用托盘天平称量25.5g硝酸钾时,误将砝码放在左盘(注:砝码最小值为1g,1g以下用游码)
B.用量筒量取水时,俯视凹液面的最低处读数
C.将量筒中的水倒入烧杯时,有少量水溅出
D.将配制好的溶液转移到细口瓶时,不慎有少量洒落瓶外
7.【广东】如图所示为实验室中配制一定溶质质量分数的氯化钠溶液的流程图。
(第7题)
请回答下列问题:
(1)应称量 7.5 g氯化钠,需加水 42.5 mL。
(2)若称量氯化钠固体时指针向右偏转,则应 继续向左盘添加氯化钠 直到天平平衡。
(3)取上述溶液10g加水稀释到 30 g,可得到5%的氯化钠溶液。
8.实验室用密度为1.84g/mL、溶质质量分数为98%的浓硫酸和蒸馏水,配制500g溶质质量分数为20%的稀硫酸,则需要取的浓硫酸的体积与所用的量筒的量程分别为(B)。
A.54.35mL、100mL B.55.5mL、100mL
C.54.35mL、250mL D.55.5mL、250mL
【解析】要配制500g溶质质量分数为20%的稀硫酸,需要硫酸的质量为500g×20%=100g,则需要溶质质量分数为98%的浓硫酸的质量为100g÷98%≈102g,转换成体积为102g÷1.84g/mL≈55.5mL。
9.用25%的氢氧化钠溶液和5%的氢氧化钠溶液混合,配制10%的氢氧化钠溶液,则混合时两者的质量比为(B)。
A.3∶1 B.1∶3C.1∶5D.5∶1
【解析】设分别量取25%的氢氧化钠溶液xg,5%的氢氧化钠溶液yg,则y=10%,解得=。
10.下表是硝酸钾在某些温度下的溶解度,将60℃时100g 24%的硝酸钾溶液恰好变成饱和溶液可以采用的方法是:加入硝酸钾 59.6 g;或降低温度到 20 ℃。
【解析】60℃时100g 24%的硝酸钾溶液中硝酸钾的质量为100g×24%=24g,水的质量为100g-24g=76g。因为60℃时硝酸钾的溶解度为110g,所以76g水中最多溶解83.6g硝酸钾,要使溶液恰好饱和,则需要加入硝酸钾的质量为83.6g-24g=59.6g。假设100g 24%的硝酸钾溶液恰好是饱和溶液,那么硝酸钾的溶解度为≈31.6g,所以降低温度到20℃恰好变成饱和溶液。
(第11题)
11.如图所示,甲表示溶质质量分数为20%的酒精溶液,乙表示溶质质量分数为55%的酒精溶液。
(1)将两者混合,所得溶液的溶质质量分数在 Ⅱ (填“Ⅰ”“Ⅱ”或“Ⅲ”,下同)区域。
(2)向20%的酒精溶液中加入水,所得溶液的溶质质量分数在 Ⅲ 区域。
(3)向55%的酒精溶液中加入酒精,所得溶液的溶质质量分数在 Ⅰ 区域。
12.某同学在实验室进行有关浓硫酸的实验时,观察到瓶上的标签如右表所示。他从瓶中倒出100mL浓硫酸用于配制稀硫酸。问:
(1)这100mL浓硫酸的质量是多少克?其中含溶质硫酸多少克?
(2)若将这100mL浓硫酸与500mL水均匀混合,则所得稀硫酸的质量分数是多少?
(3)欲配制1000g溶质质量分数为19.6%的稀硫酸,需要多少毫升这种浓硫酸和多少克水?
【答案】(1)100mL浓硫酸的质量为100mL×1.84g/cm3=184g,其中含溶质硫酸的质量为184g×98%=180.32g。(2)由(1)可知100mL浓硫酸的质量是184g,所含硫酸的质量是180.32g,水的密度是1g/cm3,所以100mL浓硫酸与500mL水均匀混合,所得稀硫酸的质量分数为×100%≈26.4%。(3)设需要98%的浓硫酸的体积为x,根据溶液稀释前后溶质的质量不变,可得1000g×19.6%=1.84g/cm3×x×98%,解得x≈108.7cm3,即需要98%的浓硫酸108.7mL。需要水的质量为1000g-108.7cm3×1.84g/cm3≈800g。
13.【金华】20℃时,在各自盛有100g水的三个烧杯中分别加入10g甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图所示。下列说法中,正确的是(A)。
A.所得溶液可能都是饱和溶液
B.20℃时,乙溶液的溶质质量最小
C.溶液溶质的质量分数:甲>丙>乙
D.升高温度,各溶液的溶质质量分数一定变大
【解析】根据图示,甲剩余最多,乙全部溶解,丙有较小剩余,甲、丙一定饱和,乙可能饱和也可能不饱和,其中乙溶液的溶质质量最大,甲最小。溶液溶质的质量分数:乙>丙>甲。未明确甲、乙、丙的溶解度与温度的关系,无法确定升温后溶液溶质的质量分数的变化。
14.【杭州】下列操作均在室温下进行,且不考虑水分的蒸发,则溶液中溶质的溶解度和溶质质量分数都发生变化的是(B)。
A.将一定量硝酸钾不饱和溶液升温10℃
B.将一定量饱和氢氧化钙溶液升温10℃
C.取一定量蔗糖不饱和溶液,向其中加入少量蔗糖
D.取一定量氯化钠饱和溶液,向其中加入少量水
【解析】氢氧化钙的溶解度随温度的升高而降低,升温后溶解度和溶质质量分数都发生变化。
15.【佛山】
(1)某实验需要100g 8%的硫酸铜溶液,该溶液的溶质质量是 8 g,从中取10g溶液, 此溶液中溶质的质量分数是 8% 。
(2)已知每100g硫酸铜晶体中含有36g结晶水。实验室用硫酸铜晶体配制100g 8%的硫酸铜溶液,需称取硫酸铜晶体 12.5 g。
【解析】(2)由于每100g硫酸铜晶体中含有36g结晶水,所以需称取硫酸铜晶体的质量为8g×=12.5g。
16.【长春】在实验室里配制100g溶质质量分数为10%的氯化钠溶液。
(1)用氯化钠固体和蒸馏水配制溶液时,用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和 量筒 。
(2)用浓溶液配制稀溶液时,计算的依据是稀释前后 溶质 的质量保持不变。
(3)下列配制方法中,可以达到上述实验目的的是 B (填字母)。
A.将10g氯化钠固体与100g水混合溶解
B.向50g溶质质量分数为20%的氯化钠溶液中加入50g水
17.【嘉兴】为测定室温下碳酸钠的溶解度,某同学在编号为A、B、C、D的四个烧杯中各加入水100g,并分别加入取自实验室的碳酸钠固体,充分搅拌至溶解(所有操作均在室温下进行),实验数据记录如下表所示:
分析上述数据,烧杯编号为 C、D (填字母)中的溶液是饱和溶液,室温下,碳酸钠的溶解度是 40g 。
18.请根据下列实验和溶解度曲线图回答问题:(已知水的密度约为1g/cm3)
(1)溶液③的质量为 131.6 g。溶液①~⑤中,一定属于不饱和溶液的是 ① (填序号,下同);溶质的质量分数一定相等的是 ②③⑤ 。
(第18题)
(2)析出晶体的质量为 25g 。
(3)如图乙所示,M物质的溶液分别处于a、b、c、d四个点时,溶液中M的质量分数大小关系正确的是 C (填字母)。
A.c>d=b>a B.c=d>a=b
C.c>a>b=d D.c>a=b>d
初中科学浙教版八年级上册第1章 水和水的溶液第5节 物质的溶解完整版教学ppt课件: 这是一份初中科学浙教版八年级上册第1章 水和水的溶液第5节 物质的溶解完整版教学ppt课件,文件包含2022浙教版八上科学15物质的溶解4pptx、2022浙教版八上科学15物质的溶解4教学设计doc、2022浙教版八上科学15物质的溶解4学案含答案doc、搅拌mp4、称量mp4等5份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
浙教版八年级上册第5节 物质的溶解课前预习ppt课件: 这是一份浙教版八年级上册第5节 物质的溶解课前预习ppt课件,共13页。PPT课件主要包含了答看到有气泡产生,物质的溶解度,溶解度克,温度℃,KNO3,溶解度曲线,三种物质的溶解度曲线,溶解度曲线的应用,课堂测评等内容,欢迎下载使用。
科学八年级上册第5节 物质的溶解课文内容课件ppt: 这是一份科学八年级上册第5节 物质的溶解课文内容课件ppt,共60页。PPT课件主要包含了故事冲糖水的故事,建立假设,冒气泡,实验表明,溶解性,知识冲浪,爱迪生的问题,拓展提升,第5节物质的溶解,第二课时等内容,欢迎下载使用。














