






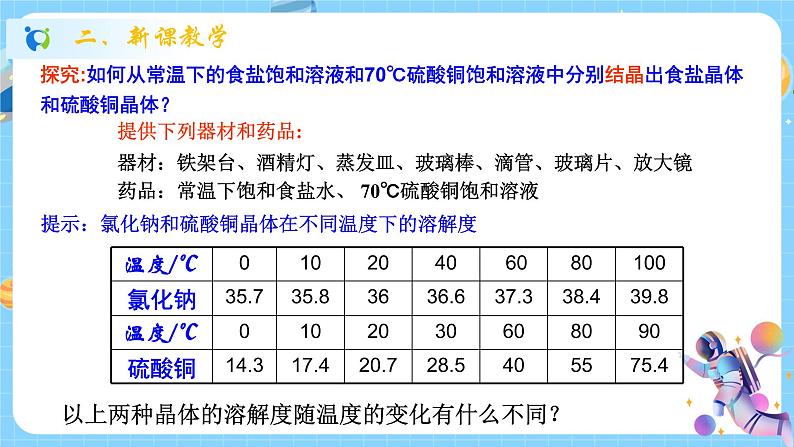





科学八年级上册第6节 物质的分离备课ppt课件
展开物质的分离(1)
1.关于溶液中晶体的析出,下列叙述正确的是( )。
A.海水一经降温,就会有大量食盐晶体析出
B.加热蒸发硝酸钾溶液,开始时就会有大量硝酸钾晶体析出
C.硝酸钾的饱和溶液还可以溶解硝酸钾
D.将析出硝酸钾晶体后的溶液再冷却,仍然有硝酸钾晶体析出
(第2题)
2.如图所示为碳酸钠和碳酸氢钠这两种晶体在不同温度下的溶解度曲线。若要除去碳酸氢钠固体中的少量碳酸钠,从溶解和结晶的角度考虑,应采用的正确方法是( )。
A.先全部溶解,再冷却热饱和溶液
B.先全部溶解,再蒸发结晶
C.先全部溶解,再蒸发大部分溶剂,最后趁热过滤
D.先全部溶解,再趁热过滤,最后蒸发全部溶剂
3.【雅安】高氯酸钾可用作火箭推进剂,其溶解度如右表所示,下列说法中,不正确的是( )。
A.高氯酸钾的溶解度随温度的降低而减小
B.20℃时,将2g高氯酸钾溶于98g水中,所得溶液中溶质的质量分数小于2%
C.60℃时,高氯酸钾饱和溶液中溶质的质量分数小于7.3%
D.将80℃的高氯酸钾溶液冷却至40℃,肯定有晶体析出
4.我国青海湖是一个典型的咸水湖,水中溶解有大量的食盐和纯碱,有“夏捞盐,冬捞碱”一说,其中的碱指纯碱(即碳酸钠)。含有碳酸钠的湖泊在冬季结冰时,湖底常有碳酸钠晶体析出,这是因为( )。
A.碳酸钠难溶于水
B.碳酸钠的溶解度随温度升高而增大
C.碳酸钠的溶解度随温度升高而减小
D.温度变化对碳酸钠的溶解度影响不大
5.带有结晶水的硫酸铜、云母、食盐、硝酸钾等都属于晶体。晶体的两大特点为 、 。上述晶体中,有一种晶体的形状为针状,应该是 晶体。
6.结晶的方法有以下两种:
(1)食盐等物质的溶解度受温度影响不大,要使这类溶质从溶液中析出,通常可采
用 的方法;用该方法将溶液从不饱和变成饱和的过程中溶质质量分数 (填“变大”“变小”或“不变”,下同),恒温条件下,析出晶体后的母液与食盐饱和溶液相比溶质质量分数 。
(2)硝酸钾等物质的溶解度受温度影响较大,要使这类溶质从溶液中析出,通常可采
用 的方法;用该方法将溶液从不饱和变成饱和的过程中溶质质量分数 (填“变大”“变小”或“不变”,下同),析出晶体后的母液与硝酸钾饱和溶液相比溶质质量分数 。
(第7题)
7.海水是一种宝贵的资源,人们可以从海水中获得多种有用物质。请回答下列问题:
(1)“海水晒盐”所采用的方法是 (填字母)。
A.冷却结晶 B.蒸发结晶 C.过滤
(2)海上航行缺乏饮用水时可采用如图所示的装置获得淡水,用该装置将2000g含3%氯化钠的海水暴晒4h后,剩余海水中氯化钠的质量分数为4%,则收集到的可饮用水为 g。
(3)海水中的硼酸可用于玻璃行业,如下表所示为硼酸的部分溶解度数据:
①由表可知,硼酸的溶解度随温度的升高而 (填“增大”“减小”或“不变”)。
②60℃时100g硼酸饱和溶液中含有硼酸 g(结果保留整数)。
8.浙西山区蕴藏有大量的石灰石,开采所得的石灰石(主要成分是碳酸钙)经高温煅烧可制得生石灰(氧化钙),生石灰与水化合反应而制得熟石灰(即氢氧化钙),同时放出大量热。熟石灰在部分温度下的溶解度如下表所示:
(1)20℃时,将0.56g氧化钙放入到盛有100g水的烧杯中。恢复到20℃时,所得溶液中水的质量 (填“增大”“减小”或“不变”)。
(2)采用一种操作方法,将上述烧杯中的剩余固体全部溶解,变为不饱和溶液。下列说法中,正确的是 (填字母)。
A.溶液的质量可能不变
B.溶液中溶质的质量分数一定减小
C.溶液中溶质的质量一定增大
D.可以升温使之变成不饱和溶液
9.下列说法中,正确的是( )。
A.从溶液中结晶析出的晶体都含结晶水
B.结晶水合物里有水分子,所以它是混合物
C.饱和溶液冷却析出晶体后的溶液一定是饱和的
D.从热的硝酸钾饱和溶液中获得硝酸钾晶体的最好方法是蒸发溶剂
10.混合物分离的方法在生产、生活和科学实验中有广泛的应用。下列做法中,应用
结晶方法的是( )。
A.除去混浊水中的泥沙 B.分离豆浆和豆渣(制作豆浆的最后一道工序)
C.除去混在铜粉中的铁粉 D.从脱色后的蔗糖水中提取“白糖”
11.在温度不变时,某固态物质的溶液M经过如图所示的变化。下列结论中,不正确的是( )。
A.第一次蒸发5g水,因为无晶体析出,所以M2溶液不一定是饱和溶液
B.第二次蒸发5g水,因为有晶体析出,所以M3溶液一定是饱和溶液
C.第一次蒸发5g水,因为无晶体析出,所以M2和M3溶液的溶质质量分数可能相等
D.第二次蒸发5g水,析出2g晶体,若将M3溶液再蒸发5g水,析出的晶体一定是2g
12.如图所示为利用海水提取粗盐的过程。根据图中原理,下列说法中,正确的是( )。
(第12题)
A.进入贮水池后,海水的成分基本不变
B.在蒸发池中,海水中氯化钠的质量逐渐增加
C.在蒸发池中,海水中水的质量逐渐增加
D.析出晶体后的母液是氯化钠的不饱和溶液
13.要从饱和食盐水中获得食盐晶体,下列实验中,能成功的是( )。
A. B. C. D.
14.【昆明】在80℃时,物质A的溶解度比B小。分别取等质量的A、B两物质的饱和溶液,降温至30℃,析出A、B晶体的质量分别为mg和ng(A、B均不含结晶水)。下列判断中,正确的是( )。
A.80℃时,A的饱和溶液与B的饱和溶液相比,前者所含溶质的质量一定比后者小
B.30℃时,若A的溶解度比B大,则m一定小于n
C.30℃时,若A的溶解度比B小,则m一定大于n
D.30℃时,A的饱和溶液与B的饱和溶液相比,后者溶质的质量分数一定比前者大
15.九年级科学课中,我们将会学习:氯化钠等晶体溶于水后,电离生成氯离子(阴离子)和钠离子(阳离子)并分散在水中能自由运动。在一定条件下,某一容器内含有三种微观粒子,一种是阳离子,另一种是阴离子,还有一种是分子,且三种微观粒子处于自由移动的状态。当改变条件后,容器内的部分阳离子和部分阴离子便处于不能自由运动的状态。这个过程属于( )。
A.结晶 B.蒸馏 C.溶解 D.过滤
(第16题)
16.氯化钠、硝酸钾、硒酸镉的溶解度曲线如图所示。据图回答下列问题:
(1)溶解度变化受温度影响最大的是 ,溶解度受温度影响最小的是 。
(2)t℃时,将25g硒酸镉加入 g水中,完全溶解后,恰好得到饱和溶液。要进一步提高该溶液的溶质质量分数,可进行的操作是 。
(3)硝酸钾溶液中含有少量氯化钠杂质,提纯的方法是 。
17.工业上利用太阳能进行海水晒盐。已知海水蒸发浓缩过程中析出盐的种类和质量如下表所示:(表中数据为每升海水在浓缩过程中析出各种盐的质量,单位为g)
(1)海水从密度为1.21g/mL浓缩到1.22g/mL时发生的变化是 (填字母)。
A.各种盐的溶解度增大
B.海水中水的质量不变
C.析出粗盐中氯化钠的质量分数增大
D.海水中Br-(溴离子)的质量分数不变
(2)海水在浓缩过程中,最先析出的盐是 。实际晒盐生产中,海水的密度一般控制在1.21~1.26g/mL范围内。由上表可知,所得粗盐中含有的杂质有 。
(3)下列图像中,能较正确地反映浓缩过程中海水中氯化钠(NaCl)的质量分数(A%)与海水密度(ρ)的关系的是 (填字母)。
AB.C.D.
答案:
1.关于溶液中晶体的析出,下列叙述正确的是(D)。
A.海水一经降温,就会有大量食盐晶体析出
B.加热蒸发硝酸钾溶液,开始时就会有大量硝酸钾晶体析出
C.硝酸钾的饱和溶液还可以溶解硝酸钾
D.将析出硝酸钾晶体后的溶液再冷却,仍然有硝酸钾晶体析出
(第2题)
2.如图所示为碳酸钠和碳酸氢钠这两种晶体在不同温度下的溶解度曲线。若要除去碳酸氢钠固体中的少量碳酸钠,从溶解和结晶的角度考虑,应采用的正确方法是(C)。
A.先全部溶解,再冷却热饱和溶液
B.先全部溶解,再蒸发结晶
C.先全部溶解,再蒸发大部分溶剂,最后趁热过滤
D.先全部溶解,再趁热过滤,最后蒸发全部溶剂
3.【雅安】高氯酸钾可用作火箭推进剂,其溶解度如右表所示,下列说法中,不正确的是(D)。
A.高氯酸钾的溶解度随温度的降低而减小
B.20℃时,将2g高氯酸钾溶于98g水中,所得溶液中溶质的质量分数小于2%
C.60℃时,高氯酸钾饱和溶液中溶质的质量分数小于7.3%
D.将80℃的高氯酸钾溶液冷却至40℃,肯定有晶体析出
4.我国青海湖是一个典型的咸水湖,水中溶解有大量的食盐和纯碱,有“夏捞盐,冬捞碱”一说,其中的碱指纯碱(即碳酸钠)。含有碳酸钠的湖泊在冬季结冰时,湖底常有碳酸钠晶体析出,这是因为(B)。
A.碳酸钠难溶于水
B.碳酸钠的溶解度随温度升高而增大
C.碳酸钠的溶解度随温度升高而减小
D.温度变化对碳酸钠的溶解度影响不大
5.带有结晶水的硫酸铜、云母、食盐、硝酸钾等都属于晶体。晶体的两大特点为 有固定的熔化温度(即熔点) 、 有规则的形状 。上述晶体中,有一种晶体的形状为针状,应该是 硝酸钾 晶体。
6.结晶的方法有以下两种:
(1)食盐等物质的溶解度受温度影响不大,要使这类溶质从溶液中析出,通常可采用 蒸发溶剂 的方法;用该方法将溶液从不饱和变成饱和的过程中溶质质量分数 变大 (填“变大”“变小”或“不变”,下同),恒温条件下,析出晶体后的母液与食盐饱和溶液相比溶质质量分数 不变 。
(2)硝酸钾等物质的溶解度受温度影响较大,要使这类溶质从溶液中析出,通常可采用 冷却热饱和溶液 的方法;用该方法将溶液从不饱和变成饱和的过程中溶质质量分数 不变 (填“变大”“变小”或“不变”,下同),析出晶体后的母液与硝酸钾饱和溶液相比溶质质量分数 变小 。
(第7题)
7.海水是一种宝贵的资源,人们可以从海水中获得多种有用物质。请回答下列问题:
(1)“海水晒盐”所采用的方法是 B (填字母)。
A.冷却结晶 B.蒸发结晶 C.过滤
(2)海上航行缺乏饮用水时可采用如图所示的装置获得淡水,用该装置将2000g含3%氯化钠的海水暴晒4h后,剩余海水中氯化钠的质量分数为4%,则收集到的可饮用水为 500 g。
(3)海水中的硼酸可用于玻璃行业,如下表所示为硼酸的部分溶解度数据:
①由表可知,硼酸的溶解度随温度的升高而 增大 (填“增大”“减小”或“不变”)。
②60℃时100g硼酸饱和溶液中含有硼酸 13 g(结果保留整数)。
8.浙西山区蕴藏有大量的石灰石,开采所得的石灰石(主要成分是碳酸钙)经高温煅烧可制得生石灰(氧化钙),生石灰与水化合反应而制得熟石灰(即氢氧化钙),同时放出大量热。熟石灰在部分温度下的溶解度如下表所示:
(1)20℃时,将0.56g氧化钙放入到盛有100g水的烧杯中。恢复到20℃时,所得溶液中水的质量 减小 (填“增大”“减小”或“不变”)。
(2)采用一种操作方法,将上述烧杯中的剩余固体全部溶解,变为不饱和溶液。下列说法中,正确的是 BC (填字母)。
A.溶液的质量可能不变
B.溶液中溶质的质量分数一定减小
C.溶液中溶质的质量一定增大
D.可以升温使之变成不饱和溶液
9.下列说法中,正确的是(C)。
A.从溶液中结晶析出的晶体都含结晶水
B.结晶水合物里有水分子,所以它是混合物
C.饱和溶液冷却析出晶体后的溶液一定是饱和的
D.从热的硝酸钾饱和溶液中获得硝酸钾晶体的最好方法是蒸发溶剂
10.混合物分离的方法在生产、生活和科学实验中有广泛的应用。下列做法中,应用
结晶方法的是(D)。
A.除去混浊水中的泥沙
B.分离豆浆和豆渣(制作豆浆的最后一道工序)
C.除去混在铜粉中的铁粉
D.从脱色后的蔗糖水中提取“白糖”
11.在温度不变时,某固态物质的溶液M经过如图所示的变化。下列结论中,不正确的是(D)。
A.第一次蒸发5g水,因为无晶体析出,所以M2溶液不一定是饱和溶液
B.第二次蒸发5g水,因为有晶体析出,所以M3溶液一定是饱和溶液
C.第一次蒸发5g水,因为无晶体析出,所以M2和M3溶液的溶质质量分数可能相等
D.第二次蒸发5g水,析出2g晶体,若将M3溶液再蒸发5g水,析出的晶体一定是2g
12.如图所示为利用海水提取粗盐的过程。根据图中原理,下列说法中,正确的是(A)。
(第12题)
A.进入贮水池后,海水的成分基本不变
B.在蒸发池中,海水中氯化钠的质量逐渐增加
C.在蒸发池中,海水中水的质量逐渐增加
D.析出晶体后的母液是氯化钠的不饱和溶液
13.要从饱和食盐水中获得食盐晶体,下列实验中,能成功的是(C)。
A. B. C. D.
14.【昆明】在80℃时,物质A的溶解度比B小。分别取等质量的A、B两物质的饱和溶液,降温至30℃,析出A、B晶体的质量分别为mg和ng(A、B均不含结晶水)。下列判断中,正确的是(B)。
A.80℃时,A的饱和溶液与B的饱和溶液相比,前者所含溶质的质量一定比后者小
B.30℃时,若A的溶解度比B大,则m一定小于n
C.30℃时,若A的溶解度比B小,则m一定大于n
D.30℃时,A的饱和溶液与B的饱和溶液相比,后者溶质的质量分数一定比前者大
【解析】虽然80℃时,物质A的溶解度比B小,但是80℃时,A的饱和溶液与B的饱和溶液的质量不知道,所以无法比较两者所含溶质的质量的大小;若30℃时A的溶解度比B大,而80℃时A的溶解度比B小,则说明B的溶解度受温度影响较大,所以等质量的A、B两物质的饱和溶液,降温至30℃时,B物质的溶液析出的晶体多,m一定小于n;若30℃时A的溶解度比B小,而80℃时A的溶解度也比B小,则不能说明A、B的溶解度哪一个受温度影响较大,所以无法比较m、n的大小;因为30℃时A、B的溶解度大小不知道,所以无法比较30℃时A的饱和溶液与B的饱和溶液的溶质质量分数大小。
15.九年级科学课中,我们将会学习:氯化钠等晶体溶于水后,电离生成氯离子(阴离子)和钠离子(阳离子)并分散在水中能自由运动。在一定条件下,某一容器内含有三种微观粒子,一种是阳离子,另一种是阴离子,还有一种是分子,且三种微观粒子处于自由移动的状态。当改变条件后,容器内的部分阳离子和部分阴离子便处于不能自由运动的状态。这个过程属于(A)。
A.结晶 B.蒸馏 C.溶解 D.过滤
【解析】某一容器内含有三种微观粒子,一种是阳离子,另一种是阴离子,还有一种是分子,且三种微观粒子处于自由移动的状态。当改变条件后,容器内的部分阳离子和部分阴离子便处于不能自由运动的状态,说明由液态变为固态,故此过程是结晶。
(第16题)
16.氯化钠、硝酸钾、硒酸镉的溶解度曲线如图所示。据图回答下列问题:
(1)溶解度变化受温度影响最大的是 硝酸钾 ,溶解度受温度影响最小的是 氯化钠 。
(2)t℃时,将25g硒酸镉加入 50 g水中,完全溶解后,恰好得到饱和溶液。要进一步提高该溶液的溶质质量分数,可进行的操作是 降低温度,再加入硒酸镉,搅拌使之溶解 。
(3)硝酸钾溶液中含有少量氯化钠杂质,提纯的方法是冷却热饱和溶液。
17.工业上利用太阳能进行海水晒盐。已知海水蒸发浓缩过程中析出盐的种类和质量如下表所示:(表中数据为每升海水在浓缩过程中析出各种盐的质量,单位为g)
(1)海水从密度为1.21g/mL浓缩到1.22g/mL时发生的变化是 C (填字母)。
A.各种盐的溶解度增大
B.海水中水的质量不变
C.析出粗盐中氯化钠的质量分数增大
D.海水中Br-(溴离子)的质量分数不变
(2)海水在浓缩过程中,最先析出的盐是 硫酸钙 。实际晒盐生产中,海水的密度一般控制在1.21~1.26g/mL范围内。由上表可知,所得粗盐中含有的杂质有 硫酸钙、氯化镁、硫酸镁、溴化钠 。
(3)下列图像中,能较正确地反映浓缩过程中海水中氯化钠(NaCl)的质量分数(A%)与海水密度(ρ)的关系的是 B (填字母)。
AB.C.D.
【解析】(2)由表中数据可知最先析出的盐是硫酸钙,海水的密度在1.21~1.26g/mL范围内,除了氯化钠,析出的晶体还有硫酸钙、氯化镁、硫酸镁、溴化钠。(3)因为浓缩过程中水分减少,氯化钠的质量不变,所以氯化钠的质量分数增大,达到饱和后,由于温度不变溶解度不变,所以溶质质量分数不变。
初中科学浙教版八年级上册第6节 物质的分离优秀教学课件ppt: 这是一份初中科学浙教版八年级上册第6节 物质的分离优秀教学课件ppt,文件包含2022浙教版八上科学16物质的分离1pptx、2022浙教版八上科学16物质的分离1教学设计doc、2022浙教版八上科学16物质的分离1学案含答案doc、冷却热饱和溶液mp4、海水晒盐mp4、硫酸铜晶体制备wmv等6份课件配套教学资源,其中PPT共29页, 欢迎下载使用。
浙教版八年级上册第1章 水和水的溶液第6节 物质的分离教课课件ppt: 这是一份浙教版八年级上册第1章 水和水的溶液第6节 物质的分离教课课件ppt,共15页。PPT课件主要包含了点击添加文本,非晶体,晶体特点,非晶体特点,硫酸铜晶体,金刚石,云母晶体,食盐晶体,方法1蒸发溶剂,例如海水晒盐等内容,欢迎下载使用。
初中科学浙教版八年级上册第6节 物质的分离示范课课件ppt: 这是一份初中科学浙教版八年级上册第6节 物质的分离示范课课件ppt,共22页。PPT课件主要包含了可溶的杂质,不溶的杂质,微生物,沉淀物,加入明矾,沉淀法,过滤法,不溶该液体的固体,滤纸紧贴漏斗内壁,过滤法注意事项等内容,欢迎下载使用。














