



高中化学人教版 (新课标)选修4 化学反应原理第三节 化学平衡评课课件ppt
展开一、可逆反应与不可逆反应
在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,叫做可逆反应。
正反应:从左向右的过程逆反应:从右向左的过程符号:
单位时间反应物浓度的减少或生成物浓度的增加
单位时间反应物浓度的增加或生成物浓度的减少
⑴同一条件下正、逆反应同时进行;
⑵可逆反应通常不能进行到底 ; 反应物的转化率不能达到100% ; 反应体系中得到的总是反应物与生成物的混合物。
绝大多数的化学反应都有一定的可逆性,但有的逆反应倾向比较弱,习惯上称为不可逆反应。
如: Ag+ + Cl- = AgCl ↓
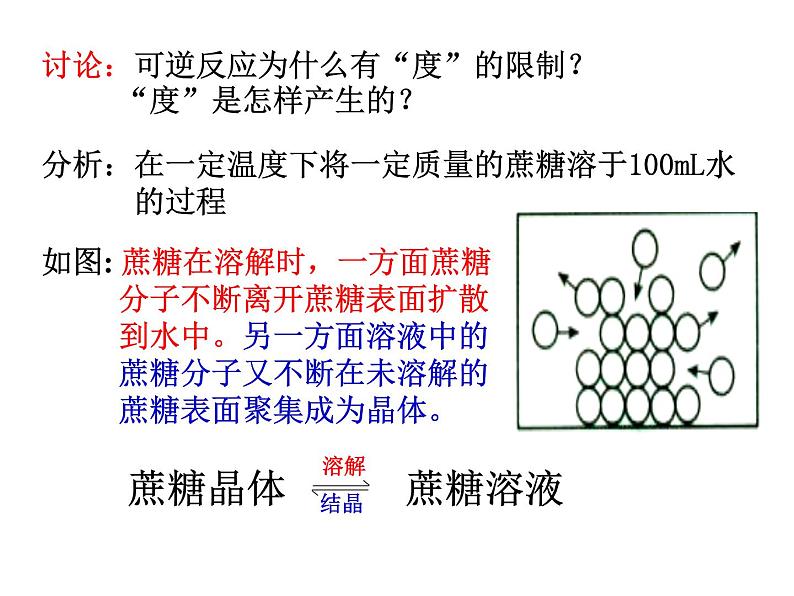
讨论:可逆反应为什么有“度”的限制? “度”是怎样产生的?
分析:在一定温度下将一定质量的蔗糖溶于100mL水 的过程
如图: 蔗糖在溶解时,一方面蔗糖 分子不断离开蔗糖表面扩散 到水中。另一方面溶液中的 蔗糖分子又不断在未溶解的 蔗糖表面聚集成为晶体。
讨论:在一定条件下达到饱和溶液后,蔗糖晶体的 质量和溶液的浓度是否变化?溶解和结晶过程 是否停止?
①开始时,v溶解 ———,v结晶=———
②然后, v溶解 —————,v结晶 ——————
③最后, v溶解 —— v结晶
“度”(限度)的产生:消耗量等于生成量, 量不再变化
对应化学平衡建立:V(速率)-t(时间)图像
那么可逆反应的情况又怎样呢?
化学平衡状态:在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应体系中所有参加反应的物质的质量或浓度保持恒定的状态。
正反应速率=逆反应速率
反应混合物中各组分的浓度保持不变的状态
2、化学平衡状态的特征
(2) 动:动态平衡(正、逆反应仍在进行)
(3) 等:正反应速率 = 逆反应速率
(5)变:条件改变,原平衡被破坏,在新的条件下建立新的平衡。
同一物质在同一单位时间内消耗的量和生成的量相等。
(4)定:反应混合物中各组分的浓度保持恒定
反应混合物各组分浓度保持不变
① 速率关系: v正= v逆
同:同一种物质的V正和V逆才能比较
等:转化后同种物质的反应速率必须相等
③气体的颜色不随时间改变而改变。 (适用于有色物质参与的反应)
②气体的密度不随时间改变而改变。 (适用于容器体积改变的反应) 气体的平均相对分子质量不随时间改变而改变。 (只适用于反应前后气体体积不等的反应)
①混合气体的总压强、总体积、总物质的量不随 时间的改变而改变。 (只适用于反应前后气体体积不等的反应)
(气体的P总、V(g)总、n总不变)
(即各物质的 c、n、w不变)
2020-2021学年第二章 化学反应速率和化学平衡第三节 化学平衡教学ppt课件: 这是一份2020-2021学年第二章 化学反应速率和化学平衡第三节 化学平衡教学ppt课件,共19页。PPT课件主要包含了化学平衡的特征,逆等动定变,化学反应速率,催化剂,催化剂的影响等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第三节 化学平衡集体备课ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 化学平衡集体备课ppt课件,共32页。PPT课件主要包含了探究汇报,红色变深,红色变浅,橙色变深,黄色变深,化学平衡的移动,条件改变,一定时间后等内容,欢迎下载使用。
高中化学第二章 化学反应速率和化学平衡第三节 化学平衡课文内容课件ppt: 这是一份高中化学第二章 化学反应速率和化学平衡第三节 化学平衡课文内容课件ppt,共55页。PPT课件主要包含了问题一,v正=v逆,化学平衡,化学平衡状态,思考与交流,身边的平衡现象,巩固练习等内容,欢迎下载使用。













