


- 人教版 (新课标)选修4 化学反应原理 2.3 化学平衡 (第1课时 化学平衡状态) 课后练习 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 2.3 化学平衡 (第1课时 化学平衡状态) 课件 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 2.3 化学平衡(第2课时 影响化学平衡的因素-浓度、压强) 课后练习 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 2.3 化学平衡 (第3课时 影响化学平衡的因素:温度、催化剂) 课件 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 2.3 化学平衡(第3课时 影响化学平衡的因素-温度、催化剂) 课后练习 课件 0 次下载
化学第二章 化学反应速率和化学平衡第三节 化学平衡优秀课件ppt
展开第三节 化学平衡(第2课时 影响化学平衡的因素:浓度、压强)
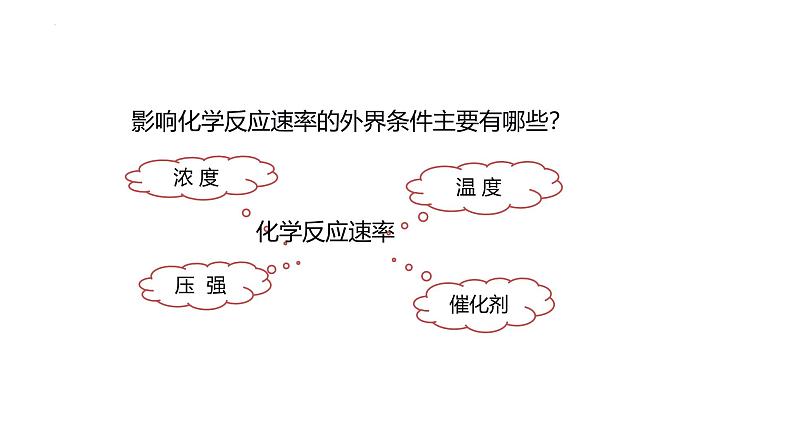
第二章 化学反应速率与化学平衡
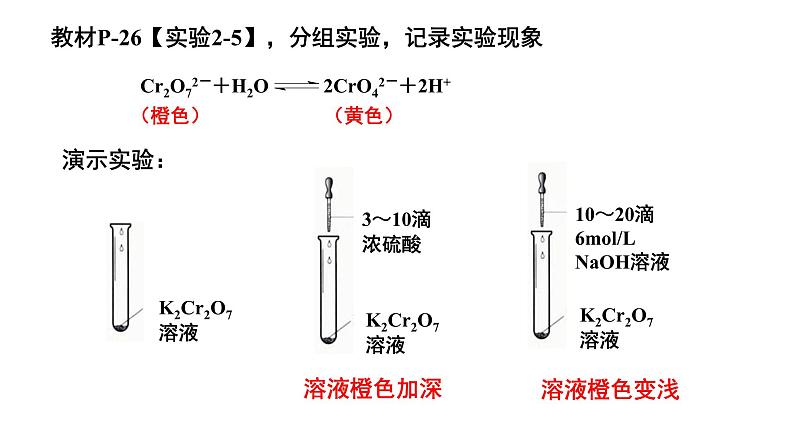
教材P-26【实验2-5】,分组实验,记录实验现象
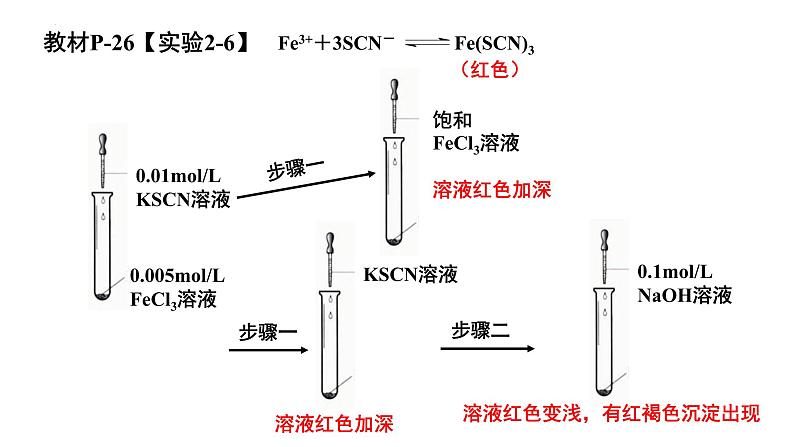
溶液红色变浅,有红褐色沉淀出现
教材P-26【实验2-6】
一、浓度对化学平衡的影响
1.上述两个实验中,化学平衡状态是否发生了改变?你是如何判断的? 2.从中你能否推知影响化学平衡状态的因素?
可逆反应中旧化学平衡的破坏、新化学平衡的建立过程叫做化学平衡的移动。
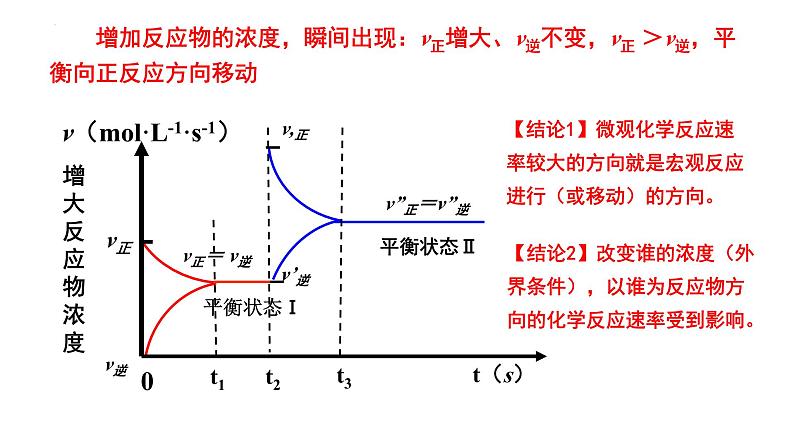
v(ml·L-1·s-1)
增加反应物的浓度,瞬间出现:v正增大、v逆不变,v正 >v逆,平衡向正反应方向移动
【结论1】微观化学反应速率较大的方向就是宏观反应进行(或移动)的方向。
【结论2】改变谁的浓度(外界条件),以谁为反应物方向的化学反应速率受到影响。
【小试牛刀】浓度对化学平衡的影响规律:在其他条件不变时
(1)增大生成物浓度,化学平衡向 反应方向移动(2)减小生成物浓度,化学平衡向 反应方向移动(3)增大反应物浓度,化学平衡向 反应方向移动(4)减小反应物浓度,化学平衡向 反应方向移动
【特别提醒】增加固体或纯液体的量不能改变其浓度,也不能改变速率,所以v正仍等于v逆,平衡不移动。
【再来一刀】可逆反应 H2O(g)+C(s) CO(g)+H2(g),在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?向哪个方向移动?CO的浓度、CO的百分含量都有何变化?
2.化学平衡移动的根本原因:v正≠v逆
你能否用速率-时间图像分别表示出: (1)增大反应物浓度(2)增大生成物浓度(3)减小反应物浓度(4)减小生成物浓度 四种变化情况下正、逆反应速率的变化情况?
【结论】 (1)改变反应物浓度瞬间,只能改变正反应速率;改变生成物浓度瞬间,只能改变逆反应速率。 (2)改变浓度瞬间,若v正>v逆,平衡向正反应方向移动,若v逆>v正,平衡向逆反应方向移动。 (3)新旧平衡速率比较: 增大浓度,新平衡速率大于旧平衡速率; 减小浓度,新平衡速率小于旧平衡速率。
【小试牛刀】可逆反应2A(g)+B(g) C(s)+D (g) 达到平衡时, 要使正反应速率下降,A的浓度增大,应采用的措施是( ) A.增大A的浓度 E.减小A的浓度 B.增大B的浓度 F.减小B的浓度 C.增大C的浓度 G.减小C的浓度 D.增大D的浓度 H.减小D的浓度
反应物A的浓度、转化率有何变化?
NH3%随着压强的增大而增大,即平衡向正反应的方向移动。
说明:增大压强,正逆反应速率均增大,但增大倍数不一样,平衡向着体积缩小的方向移动
二、压强对化学平衡的影响:
v(ml·L-1·s-1)
速率-时间(v-t)关系图:
【结论3-1】增大压强,正逆方向化学反应速率均增加,体积减小方向增加的程度更大。
反应体系中有气体参加且反应 前后总体积发生改变。
对于反应前后气体体积发生变化的化学反应,在其它条件不变的情况下: 增大压强,平衡向气体体积缩小的方向移动, 减小压强,平衡向气体体积增大的方向移动。
3、速率-时间关系图:
【结论3-2】减小压强,正逆方向化学反应速率均减小,体积减小方向减小的程度更大。
【结论3】改变压强,正逆方向化学反应速率同方向改变,体积减小方向变化的程度更大。
思考:对于等体积的气体反应,压强改变将怎样影响化学平衡?
结论:增大压强,正逆反应速率同时增大,但增大倍数一样, v’正=v’逆,平衡不移动,但反应速率改变。
在反应I2(g)+H2 (g) 2HI (g)中增大压强
注意:压强变化若没有浓度的变化,化学反应速率不变,化学平衡不移动。
2NO2(g) N2O4(g)
①当加压气体体积缩小时,混合气体颜色先变深是由于NO2浓度增大, 后又逐渐变浅是由于平衡向正反应方向移动; ②当减压气体体积增大时,混合气体颜色先变浅是由于NO2浓度减小, 后又逐渐变深是由于平衡向逆反应方向移动。
1.(双选)压强的变化不会使下列反应的平衡发生移动的是( )A.H2(g)+I2(g) 2HI(g)B. N2(g)+3H2(g) 2NH3(g)C.2SO2(g)+O2(g) 2SO3(g) D. C(s)+CO2(g) 2CO(g) E . Fe3++n SCN- [Fe(SCN)n] 3-n
2.恒温下,反应aX(g) bY(g)+cZ(g)达到平衡后,把容器体积压缩到原来的一半且达到新平衡时,X的物质的量浓度由0.1ml/L增大到0.19ml/L,下列判断正确的是( ) A.a>b+c B. a<b+c C.a=b+c D. a=b=c
3.在一定条件下,下列可逆反应达到化学平衡: I2(g)+H2(g) 2HI(g) △H<0,要使混合气体的颜色加深,可以采取的方法是( ) A.降低温度 B.增大H2的浓度 C.增大压强 D.减小压强
高中化学第二章 化学反应速率和化学平衡第二节 影响化学反应速率的因素优质课件ppt: 这是一份高中化学<a href="/hx/tb_c22165_t3/?tag_id=26" target="_blank">第二章 化学反应速率和化学平衡第二节 影响化学反应速率的因素优质课件ppt</a>,共21页。PPT课件主要包含了催化剂等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第三节 化学平衡课文内容ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 化学平衡课文内容ppt课件,共28页。PPT课件主要包含了探究一,探究二等内容,欢迎下载使用。
高中人教版 (新课标)第二节 影响化学反应速率的因素评课课件ppt: 这是一份高中人教版 (新课标)第二节 影响化学反应速率的因素评课课件ppt,共25页。PPT课件主要包含了探究一,探究二等内容,欢迎下载使用。













