





- 人教版 (新课标)选修4 化学反应原理 2.3 化学平衡 (第2课时 影响化学平衡的因素:浓度、压强) 课件 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 2.3 化学平衡(第2课时 影响化学平衡的因素-浓度、压强) 课后练习 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 2.3 化学平衡(第3课时 影响化学平衡的因素-温度、催化剂) 课后练习 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 2.3 化学平衡(第4课时 化学平衡常数) 课件 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 2.3 化学平衡 (第4课时 化学平衡常数) 课后练习 课件 0 次下载
高中化学人教版 (新课标)选修4 化学反应原理第三节 化学平衡精品ppt课件
展开2.化学平衡移动的根本原因:v正≠v逆
1.化学平衡状态的重要特征:v正=v逆
外界条件如浓度、压强、温度、催化剂的变化对化学反应速率产生影响,就可能导致化学反应速率变化后出现v正≠v逆。
【结论1】微观化学反应速率较大的方向就是宏观反应进行(或移动)的方向。
【结论2】改变谁的浓度(外界条件),以谁为反应物方向的化学反应速率受到影响。
【结论3】改变压强,正逆方向化学反应速率同方向改变,体积减小方向变化的程度更大。
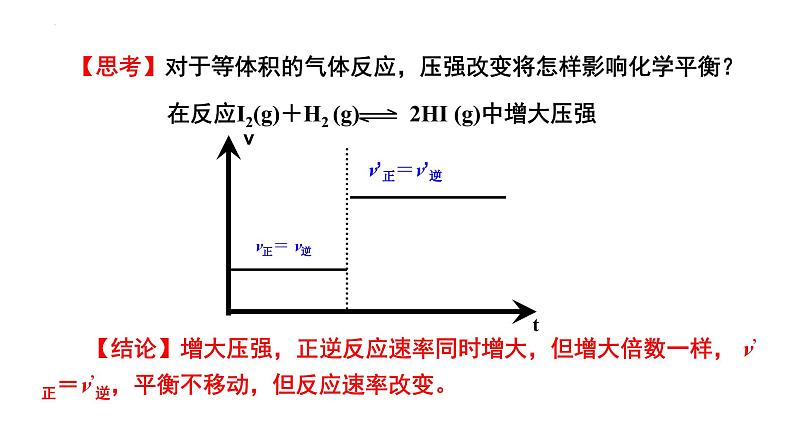
【思考】对于等体积的气体反应,压强改变将怎样影响化学平衡?
【结论】增大压强,正逆反应速率同时增大,但增大倍数一样, v’正=v’逆,平衡不移动,但反应速率改变。
在反应I2(g)+H2 (g) 2HI (g)中增大压强
【讨论】在密闭容器中发生反应:N2(g)+3H2 (g) 2NH3 (g) ,充入He气体: (1)容积不变时,反应物质浓度_____,反应速率______ ,化学平衡_______; (2)气体压强不变时,容器的体积____,各气体的浓度_____, 反应速率_____,化学平衡向_______方向移动。
【注意】压强变化若没有浓度的变化,化学反应速率不变,化学平衡不移动。
【小试牛刀】有的同学认为,在KSCN溶液与的FeCl3溶液的反应平衡体系中加入KCl晶体会对化学平衡有影响,而且平衡会正向移动。你同意他的观点吗?
【再来一刀】下列三个可逆反应达到平衡后,当改变压强时,平衡是否移动?怎样移动?① N2+3H2 2NH3 ②H2+I2(气) 2HI③CO2+C(固) 2CO
三、温度对化学平衡的影响:
在其它条件不变的情况下,升高温度,平衡向吸热反应方向移动。 降低温度,平衡向放热反应方向移动。
在其它条件不变的情况下,升高温度,不管是吸热反应还是放热反应,反应速率都增大,但吸热反应增大的倍数大于放热反应增大的倍数,故平衡向吸热反应的方向移动。
3.速率-时间关系图解释
【结论4-1】升温,v正、v逆均增加,吸热方向的化学反应速率增加的程度更大。
结论:降低温度,化学平衡向放热的方向移动。
【结论4-2】降温,v正、v逆均减小,吸热方向的化学反应速率减小的程度更大。
【结论4】改变温度,正逆方向化学反应速率同方向改变,吸热方向变化的程度更大。
升高温度,化学平衡向吸热的方向移动
降低温度,化学平衡向放热的方向移动
化学平衡的移动能削弱温度改变给可逆反应所带来的影响,但并不能完全抵消。
四、催化剂对化学平衡的影响:
催化剂的使用同等程度地改变正、逆化学反应速率,不影响化学平衡的移动。
结论:催化剂不能使化学平衡发生移动;不能改变反应混合物的百分含量;但可以改变达到平衡的时间。
勒夏特列原理(平衡移动原理)
如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。
适用于任何动态平衡体系
能影响化学平衡的外界条件的变化
“减弱”外界条件的影响,而不能消除外界条件的影响。
在工业生产中通过以下途径提高合成氨的产率,利用有关知识分析采取这些措施的原因: 1.向反应器中注入过量N2 2.采用适当的催化剂 3.在高压下进行反应 4.在较高温度下进行反应
思考并完成下列表格 2SO2(g)+O2(g) 2SO3(g)
向右即O2浓度减小的方向
向右即SO3浓度增大的方向
【小试牛刀】在密闭容器中的可逆反应: CO+NO2 (g) CO2 (g)+NO △H<0 达平衡后,只改变下列的一个条件,填写有关的空白:
①增大容器的体积,平衡 ,c(NO2)将 ,反应混合物的颜色 。②升高温度,平衡 ,体系的压强 。③加入催化剂,平衡 ,NO2的物质的量 。④通入O2,反应体系的颜色 ,NO的物质的量 。⑤通入N2 ,体系压强 ,平衡 。
1.下列事实中不能用平衡移动原理解释的是( ) A.密闭、低温是存放氨水的必要条件 B.实验室用排饱和食盐水法收集氯气 C.硝酸工业生产中,使用过量空气以提高NH3的利用率 D.在FeSO4溶液中,加入铁粉以防止氧化
2.反应2X(g)+Y(g) 2Z (g) △H<0 ,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间的关系如图所示,下述判断正确的是( )A. T1<T2 , P1<P2 B. T1<T2 ,P1>P2 C. T1>T2 ,P1>P2 D. T1>T2 ,P1<P2
化学选修4 化学反应原理第二节 影响化学反应速率的因素试讲课课件ppt: 这是一份化学选修4 化学反应原理<a href="/hx/tb_c22165_t3/?tag_id=26" target="_blank">第二节 影响化学反应速率的因素试讲课课件ppt</a>,共18页。PPT课件主要包含了组织建设,催化剂,内因主要,物质本身的结构和性质等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第三节 化学平衡课文内容ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 化学平衡课文内容ppt课件,共28页。PPT课件主要包含了探究一,探究二等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第二节 影响化学反应速率的因素评课课件ppt: 这是一份人教版 (新课标)选修4 化学反应原理第二节 影响化学反应速率的因素评课课件ppt,共22页。PPT课件主要包含了探究一,探究二等内容,欢迎下载使用。













