






初中化学人教版九年级下册第九单元 溶液综合与测试说课课件ppt
展开一、选择题(每小题3分,共36分)1.(独家原创试题)成贵高铁是中国的第一条山区高铁,也是全球第一条山 区高铁,将于2019年全面开通。高铁列车上给乘客准备了种类丰富的以下 饮品,其中属于溶液的是 ( )A.可乐 B.酸奶 C.果粒橙 D.玉米糊
答案 A 可乐是均一、稳定的混合物,属于溶液;酸奶不均一、不稳定,属 于乳浊液;果粒橙属于悬浊液;玉米糊不均一、不稳定,属于悬浊液。
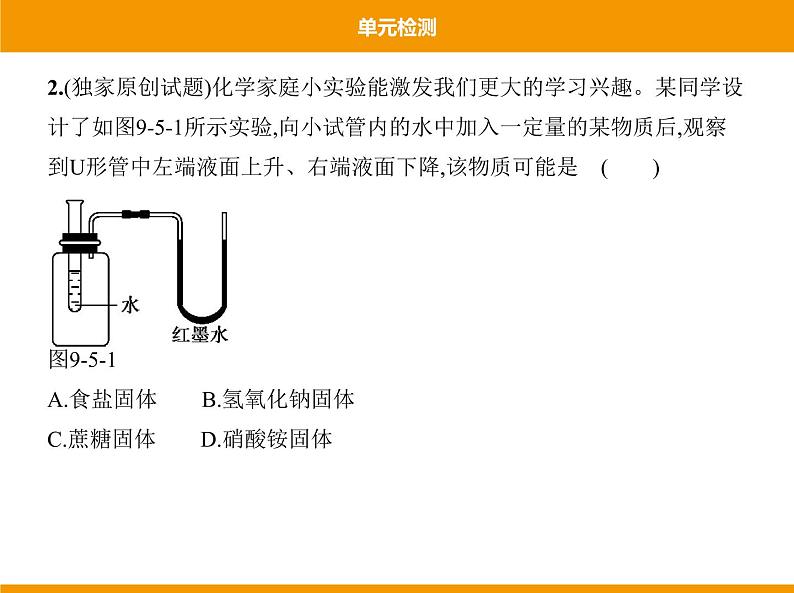
2.(独家原创试题)化学家庭小实验能激发我们更大的学习兴趣。某同学设 计了如图9-5-1所示实验,向小试管内的水中加入一定量的某物质后,观察 到U形管中左端液面上升、右端液面下降,该物质可能是 ( ) 图9-5-1A.食盐固体 B.氢氧化钠固体C.蔗糖固体 D.硝酸铵固体
答案 D 氯化钠溶于水时溶液温度几乎不变,U形管中的液面无明显变 化;氢氧化钠溶于水放出大量的热,溶液温度升高,瓶内气体受热膨胀,体积 变大,U形管中液面右端上升;蔗糖溶于水时溶液温度几乎不变,U形管中的 液面无明显变化;硝酸铵溶于水时吸收热量,溶液温度降低,瓶内气体遇冷 体积变小,U形管中液面右端降低,左端升高。
3.(独家原创试题)准确配制一定溶质质量分数的溶液在生产、生活中具有 十分重要的意义。欲配制质量分数为6%的NaCl溶液,下列有关操作正确 的是 ( )
答案 D 取氯化钠固体时,瓶塞应倒放在桌面上;称量氯化钠固体时,砝码 应放在托盘天平的右盘,氯化钠应放在左盘;量取水读数时,视线应该与凹 液面最低处保持水平;溶解氯化钠时使用玻璃棒搅拌,目的是加快氯化钠溶 解。
4.(2018广东广州越秀一模)现需要将溶质质量分数为40%的氢氧化钠溶液 稀释为40 g 溶质质量分数为5%的氢氧化钠溶液。此时,需要加入水的体 积为 ( )A.38 mL B.36 mL C.35 mL D.37 mL
答案 C 设需要加入水的质量为x,(40 g-x)×40%=40 g×5%,解得x=35 g,体 积为35 mL。
5.(2019安徽模拟)下列洗涤或除污过程应用乳化原理的是 ( )A.用钢丝球刷除炒菜锅上的污垢B.用酒精除去衣服上的碘C.用汽油除去衣服上的油污D.用洗洁精洗去餐具上的油脂
答案 D 用钢丝球刷除炒菜锅上的污垢是利用了钢丝球的摩擦作用,不 是利用了乳化作用;用酒精除去衣服上的碘,利用的是溶解原理;用汽油洗 去油污,利用的是溶解原理;洗洁精有乳化作用,能将大的油滴分散成细小 的液滴随水流走。
6.(2019山东威海中考)下列关于溶液的说法不正确的是 ( )A.与乳化作用相比,溶解能使物质混合的更均匀B.20 ℃时,50 g水中溶解了15 g硝酸钾,则20 ℃时硝酸钾的溶解度是30 gC.一定温度下,固体物质的溶解度不随水的质量改变而改变D. 硝酸钾的饱和溶液恒温蒸发部分水后,剩余溶液溶质质量分数不变
答案 B 乳化形成的乳浊液不均一、不稳定,溶液是均一、稳定的混合 物,所以溶解比乳化混合更均匀,A说法正确;20 ℃时,50 g水中溶解了15 g硝 酸钾,没有确定是否达到饱和,无法确定20 ℃时硝酸钾的溶解度,B说法不 正确;物质溶解度的大小与溶剂的多少没有关系,C说法正确;硝酸钾溶液恒 温蒸发部分水,剩余溶液仍是饱和溶液,溶液的溶质质量分数不变,D说法正 确。
7.在图9-5-2所示的大烧杯中加入一定量的硝酸铵,溶解后甲试管内出现的 现象以及乙试管内的溶液分别是 ( ) 图9-5-2A.无明显现象;不饱和溶液B.无明显现象;饱和溶液C.有晶体析出;不饱和溶液D.有晶体析出;饱和溶液
答案 C 在大烧杯中加入一定量的硝酸铵,硝酸铵溶于水吸热,溶液温度 降低。硝酸钾的溶解度随着温度的降低而减小,温度降低后,有晶体析出, 所得溶液仍为饱和溶液;氢氧化钙的溶解度随着温度的降低而增大,温度降 低后,氢氧化钙的溶解度增大,溶液变为不饱和溶液。
8.(2019湖南益阳中考)X、Y、Z三种物质的溶解度曲线如图9-5-3所示。 下列说法正确的是 ( ) 图9-5-3A.将T2 ℃时三种物质的饱和溶液降温到T1 ℃后,溶质质量分数大小关系为 Y>X>ZB.Y的溶解度为50 gC.降低温度可使Z的不饱和溶液变成饱和溶液
D.T2 ℃时,50 g水与50 g X混合,可得到100 g X的饱和溶液
答案 A 将T2 ℃时三种物质的饱和溶液降温到T1 ℃后,X、Y溶液仍为饱 和溶液,Z溶液变为不饱和溶液,,且此时溶解度Y>X=Z,所以溶质质量分数 大小关系为Y>X>Z,A说法正确。表示某物质的溶解度,必须指明温度,B说 法不正确;Z的溶解度随温度的升高而减少,降低温度不能使Z的不饱和溶 液变成饱和溶液,C说法不正确;T2 ℃时,X的溶解度是50 g,50 g水中最多溶 解25 g X,所以T2 ℃时,50 g水与50 g X混合,得到75 g X的饱和溶液,D说法 不正确。
9.(2018浙江嘉兴中考)硝酸钾的溶解度随温度升高而增大。图9-5-4是有 关硝酸钾溶液的实验操作及变化情况。下列说法正确的是 ( ) 图9-5-4A.操作Ⅰ一定是降温B.操作Ⅰ一定是加溶质C.①与③的溶质质量一定相等D.②与③的溶质质量分数一定相等
答案 D 操作Ⅰ是将不饱和溶液转化为饱和溶液,采取的措施可能是降 温或增加溶质或蒸发溶剂等;若操作Ⅰ为降温,则①、②中溶质质量相等, ②转化为③的过程中,有硝酸钾析出,故①与③的溶质质量不相等;②与③ 均为相同温度下的饱和溶液,溶质质量分数一定相等。
10.(2019四川内江中考)实验室欲配制50克溶质质量分数为15%的氯化钠 溶液,下列有关叙述正确的是 ( )A.配制该溶液的步骤是称量和溶解B.配制过程中用到的仪器只有天平、烧杯和玻璃棒C.溶解氯化钠固体时,玻璃棒的作用是加快溶解速率D.转移溶液时,用蒸馏水洗涤烧杯2~3次,将洗涤液一并倒入试剂瓶
答案 C 配制50克溶质质量分数为15%的氯化钠溶液,首先计算配制溶 液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,A 说法错误。托盘天平用于称取固体氯化钠、量筒与胶头滴管用于准确量 取水、烧杯用于完成溶解操作、玻璃棒用于溶解时搅拌,B说法错误。溶 解氯化钠固体时,玻璃棒的作用是加快溶解速率,C说法正确。转移溶液时, 用蒸馏水洗涤烧杯2~3次,将洗涤液一并倒入试剂瓶,会稀释所配溶液,D说 法错误。
11.(2018湖南娄底中考)下列关于溶液的说法正确的是 ( )A.将硫酸钠和汽油放入水中,充分搅拌后都能形成溶液B.把30%的硝酸钾溶液均分成两份,每份溶液的溶质质量分数为15%C.向20 ℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解D.配制100 g 10%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装 瓶存放等步骤
答案 D 汽油难溶于水,将汽油放入水中,充分搅拌后不能形成溶液;溶液 具有均一性,把30%的硝酸钾溶液均分成两份,每份溶液的溶质质量分数为 30%;一种物质的饱和溶液还能溶解其他的溶质,向20 ℃时的蔗糖饱和溶 液中加入食盐,食盐能溶解;配制100 g 10%的氯化钠溶液,首先计算配制溶 液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解、 装瓶存放。
12.(2019广东广州中考)25 ℃时,探究某固体物质的溶解性,实验记录如下 表。下列实验结论正确的是 ( )
A.实验①所得溶液的溶质质量分数为10%B.实验②说明25 ℃时该物质的溶解度是20 gC.实验③④所得溶液的溶质质量分数相同D.实验④所得溶液中含溶质20 g
答案 C 实验①所得溶液的溶质质量分数为 ×100%≈9.1%,A说法不正确;25 ℃时,10 g固体加入50 g水中完全溶解,形成的溶液可能是饱和 溶液,也可能是不饱和溶液,如果是饱和溶液,则25 ℃时该物质的溶解度是2 0 g,如果是不饱和溶液,则25 ℃时该物质的溶解度大于20 g,B说法不正确; 实验③④所得溶液都是25 ℃时的饱和溶液,因此溶质质量分数相同,C说法 正确;实验④所得溶液中溶质质量小于20 g,D说法不正确。
13.(8分)溶液在生产和科研中具有广泛的用途,与人们的生活密不可分。(1)衣服上沾有的油污,可用汽油洗去,是因为汽油能 (填“溶解” 或“乳化”)油污。(2)喝了冰镇汽水以后,常常会打嗝,这种现象说明气体的溶解度与 有关(填“温度”或“压强”)。(3)大理石与稀盐酸完全反应后的溶质是 。(4)20 ℃时,使接近饱和的硝酸钾溶液变为饱和溶液的方法是 (写一种方法)。
二、填空题(共44分)
答案 (1)溶解 (2)温度 (3)氯化钙(或CaCl2) (4)增加溶质(或蒸发溶剂 等合理答案均可)
解析 (1)油污能溶于汽油,所以衣服上沾有的油污,可用汽油洗去;(2)气体 的溶解度随温度的升高而减小,所以喝了冰镇汽水以后,常常会打嗝;(3)大 理石的主要成分是碳酸钙,与盐酸反应生成氯化钙、水与二氧化碳气体,所 以完全反应后的溶质是氯化钙;(4)可通过增加溶质或蒸发溶剂等方法,使2 0 ℃时接近饱和的硝酸钾溶液变为饱和溶液。
14.(2019四川攀枝花中考)(8分)A、B、C三种固体物质的溶解度曲线如图 9-5-5所示。回答下列问题:图9-5-5(1)t1 ℃时,A、B、C三种物质中溶解度最大的是 。(2)t1 ℃时,在盛有100 g水的烧杯中,加入50 g B物质,充分溶解后,得到溶液 的质量为 g。(3)t1 ℃时,C的饱和溶液的溶质质量分数为 。
(4)将t1 ℃的A、B、C三种饱和溶液分别升温至t2 ℃,所得溶液的溶质质量 分数由大到小的顺序是 。
答案 (1)B (2)140 (3)20% (4)B>A>C
15.(2017江苏南京中考)(12分)溶液在生产、生活中起着十分重要的作 用。请回答下列问题。(1)可以作为溶质的是 。A.只有固体 B.只有液体C.只有气体 D.气体、液体、固体都可以(2)配制100 g质量分数为16%的氯化钠溶液,所需氯化钠的质量为 ,水的体积为 mL(水的密度近似看作1 g/cm3)。(3)甲、乙两种不含结晶水的固体物质的溶解度曲线如图9-5-6所示。
t1℃时,甲物质的溶解度是 。t2℃时,若从甲和乙两种物质的饱 和溶液中析出等质量的固体,须蒸发掉较多水的是 (填“甲”或 “乙”)物质的饱和溶液。(4)按图9-5-7所示装置,将液体x注入装有固体y的试管中,会导致U形管中 右端液面升高,则可能的组合是 。
答案 (1)D (2)16 g 84 (3)40 g 乙 (4)AC
解析 (1)气体、液体、固体都可以作为溶质,如盐酸中的溶质是气体,酒 精溶液中的溶质是液体,氯化钠溶液中的溶质是固体。(2)所需氯化钠的质量为100 g×16%=16 g;所需水的质量为100 g-16 g=84 g, 水的体积为 =84 mL。(3)t1℃时,甲物质的溶解度是40 g;t2℃时,甲物质的溶解度大于乙,若从甲和 乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是乙物质 的饱和溶液。(4)若使U形管中右端液面升高,则必使具支试管内压强增大。A中氢氧化 钠溶于水放出热量,温度升高,压强增大;B中硝酸铵溶于水吸热,温度降低, 压强减小;C中稀盐酸与镁反应属于放热反应,温度升高,压强增大。
16.(2019湖南郴州中考)(8分)已知 NH4Cl、KNO3 在不同温度时的溶解度如 下表:
请回答下列问题:(1)在35 ℃时,KNO3的溶解度 (填“>”“=”或“<”)NH4Cl的溶 解度。(2)若KNO3固体中含有少量NH4Cl固体,可采用 (填“蒸发结 晶”或“降温结晶”)获得KNO3晶体。(3)25 ℃时,将15克KNO3 固体溶解在50克水中,所得溶液为
(填“饱和溶液”或“不饱和溶液”)。(4)20 ℃时,饱和NH4Cl溶液的溶质质量分数为 (精确到0.1%)。
答案 (1)> (2)降温结晶 (3)不饱和溶液(4)27.1%
解析 (1)NH4Cl在30 ℃时的溶解度与KNO3在40 ℃时溶解度相等,由于NH 4Cl与KNO3的溶解度都随着温度的升高而增大,所以在35 ℃时,KNO3的溶 解度大于NH4Cl的溶解度。(2)KNO3溶解度受温度影响变化较大,若KNO3 固体中含有少量NH4Cl固体,可采用降温结晶的方法获得KNO3晶体。(3)25 ℃时,硝酸钾的溶解度在31.6 g~45.8 g之间,50克水中最多能溶解硝酸钾的 质量在15.8 g~22.9 g之间,故25 ℃时,将15克KNO3固体溶解在50克水中,所 得溶液为不饱和溶液。(4)饱和溶液的溶质质量分数= ×100%,20 ℃时,饱和NH4Cl溶液的溶质质量分数为 ×100%≈27.1%。
17.(2017重庆中考B卷)(8分)张老师在讲授溶液时,用固体M做了如下实验, 图9-5-8中甲、乙、丙、丁是充分搅拌后静置的现象,请回答相关问题(忽 略水的挥发): 图9-5-8(1)上述烧杯中,溶液质量最大的是 (填序号)。(2)上述实验可以判断物质M的溶解度曲线是图9-5-9对应的 (填序号)。
(3)甲、乙、丙烧杯中的溶液一定呈饱和状态的是 (填序号)。(4)根据图9-5-9,若要使丁烧杯中的溶液恰好达到饱和状态,还需要加入 g的M固体。
答案 (1)丁 (2)A (3)乙 (4)8
解析 (1)溶剂都为50 g,丁中溶质最多,故其质量最大;(2)30 ℃时,50 g的水 中能溶解物质M 15 g,故该温度下M的溶解度≥30 g,因此A表示物质M的 溶解度曲线;(3)烧杯乙中有固体剩余,故溶液一定饱和;(4)30 ℃时,该物质 的溶解度为46 g,故50 g水中最多溶解M 23 g,因此要恰好达到饱和,还需要 加入M的质量为23 g-15 g=8 g。
18.(2019湖南郴州中考)(14分)配制一定溶质质量分数的氯化钠溶液的过 程如图9-5-10所示: 图9-5-10
三、实验探究题(共14分)
(1)写出图中标号a仪器的名称: 。(2)配制50 g质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为: 氯化钠 g,水 g。(3)称量氯化钠时,氯化钠应放在托盘天平的(填“左”或“右”) 盘。(4)溶解过程中玻璃棒的作用是 。(5)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有 (填序号)。A.称量时,药品与砝码放反了 B.量取水的体积时,仰视读数 C.装瓶时,有少量溶液洒出(6)把50 g 质量分数为 15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是 g。
答案 (1)量筒 (2)7.5 42.5 (3)左 (4)搅拌,加快溶解的速率 (5)AB (6)100
解析 (1)由题图可知,标号a仪器的名称是量筒。(2)配制50 g质量分数为1 5%的氯化钠溶液,需要氯化钠的质量为50 g×15%=7.5 g,水的质量为50 g-7. 5 g=42.5 g。(3)称量氯化钠时,氯化钠应放在托盘天平的左盘。(4)溶解过 程中玻璃棒的作用是搅拌,加快溶解的速率。(5)称量时,药品与砝码放反 了且使用了游码,所称取的氯化钠的质量偏少,会使溶质质量分数偏小;量 取水的体积时,仰视读数,实际量取的水偏多,会使溶质质量分数偏小;装瓶 时,有少量溶液洒出,不会影响溶质的质量分数。(6)设需要水的质量是x,根 据稀释前后溶质的质量不变,可得50 g×15%=(50 g+x)×5% ,解得x=100 g。
19.(2018湖南长沙中考)(6分)小英同学用某铁合金样品做了如下实验:称量 11.4 g 样品,放入质量为40 g 的烧杯中,再往烧杯中加入200 g 稀硫酸,恰好 完全反应(杂质不与酸反应,也不溶于水)。反应完毕后称量,烧杯及烧杯内 物质总质量为251 g。求:(1)反应产生的氢气质量为 g;(2)所用稀硫酸的溶质质量分数(写出计算过程)。
答案 (1)0.4(2)设稀硫酸中溶质的质量为xFe+H2SO4 FeSO4+H2↑ 98 2 x 0.4 g = x=19.6 g 所用稀硫酸的溶质质量分数为 ×100%=9.8%答:所用稀硫酸的溶质质量分数为9.8%。
人教版九年级下册课题3 溶液的浓度课文配套课件ppt: 这是一份人教版九年级下册课题3 溶液的浓度课文配套课件ppt,文件包含课题3溶质质量分数第1课时pptx、课题3溶质质量分数第3课时pptx、课题3溶质质量分数第2课时pptx、3份氯化钠加入不同量水中mp4、三种浓度不同的硫酸铜溶液剪后mp4、哪个更甜1勺2勺糖mp4、哪个更甜mp4、溶质质量分数的概念mp4等8份课件配套教学资源,其中PPT共54页, 欢迎下载使用。
初中化学人教版九年级下册课题2 溶解度集体备课课件ppt: 这是一份初中化学人教版九年级下册课题2 溶解度集体备课课件ppt,文件包含课题2溶解度第2课时pptx、课题2溶解度第1课时pptx、课题2溶解度第3课时pptx、饱和溶液和不饱和溶液转化mp4、蒸发结晶mp4、美丽的结晶mp4、美丽的化学mp4、硝酸钾结晶配乐版wmv、硝酸钾溶于水mp4、氯化钠溶解水中mp4、硝酸钾和氯化钠的分离mp4、气体物质的溶解度定义mp4、气体物质的溶解度与温度关系mp4、气体物质的溶解度与压强关系mp4、怎样比较固体物质溶解能力的大小剪后mp4、实验9-6硝酸钾的溶解mp4、实验9-5氯化钠的溶解mp4、饱和溶液和不饱和溶液指名溶质mp4等18份课件配套教学资源,其中PPT共64页, 欢迎下载使用。
化学课题1 溶液的形成教学演示ppt课件: 这是一份化学课题1 溶液的形成教学演示ppt课件,文件包含课题1溶液的形成第1课时11版pptx、课题1溶液的形成第2课时pptx、NaCl在水中的电离00_00_03-00_00_232mp4、化学乳化现象mp4、新课导入mp4、水和乙醇能否互溶的探究实验mp4、溶解时的吸热与放热mp4、碘和高锰酸钾在汽油或水中的溶解实验第一步mp4、碘和高锰酸钾在汽油或水中的溶解实验第二步mp4、肥皂为什么能去污mp4、蔗糖溶解实验00_01_53-00_02_42mp4、蔗糖的溶解微观解释mp4等12份课件配套教学资源,其中PPT共56页, 欢迎下载使用。













