资料中包含下列文件,点击文件名可预览资料内容















还剩19页未读,
继续阅读
所属成套资源:人教版九年级下册化学课件+教案+学案+分层练习
成套系列资料,整套一键下载
【人教版】九下化学 第九单元 溶液(单元复习)(课件+教案+导学案+分层练习)
展开
这是一份【人教版】九下化学 第九单元 溶液(单元复习)(课件+教案+导学案+分层练习),文件包含9溶液单元复习pptx、9教学设计溶液单元复习docx、9练习·能力提升溶液单元复习docx、9练习·基础巩固溶液单元复习docx、9练习·素能拓展溶液单元复习docx、9预习导学溶液单元复习docx等6份课件配套教学资源,其中PPT共27页, 欢迎下载使用。
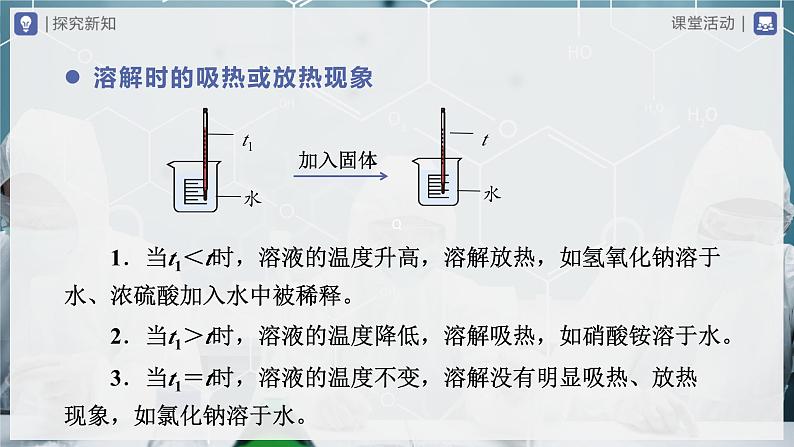
第九单元 溶液单元复习人教版化学九年级下册生理盐水、海水、面糊、泥水、牛奶、石灰乳、饮料、硫酸铜溶液请指出以上这些物质中有哪些属于溶液。 √√√√溶液的形成 1.概念:一种或几种物质分散到另一种物质里,形成______、______的混合物,叫做溶液。均一稳定 2.基本特征溶液 ①均一性;②稳定性;③混合物。 3.组成 ①溶剂:起溶解作用的物质。 ②溶质:被溶解的物质。 a.溶质可以是固体、液体或气体;固体溶于液体,固体为溶质,液体为溶剂;液体溶于液体,有水,水为溶剂,无水,量多的为溶剂。 b.溶液的质量=溶质的质量+溶剂的质量 溶液的体积<溶质的体积+溶剂的体积 注意溶解时的吸热或放热现象 3.当t1=t时,溶液的温度不变,溶解没有明显吸热、放热现象,如氯化钠溶于水。加入固体 1.当t1<t时,溶液的温度升高,溶解放热,如氢氧化钠溶于水、浓硫酸加入水中被稀释。 2.当t1>t时,溶液的温度降低,溶解吸热,如硝酸铵溶于水。乳化现象 1.乳浊液 (1)定义:小液滴分散到液体里形成的混合物。如:____、______等液体滴入到水中并用力振荡后形成的乳状浑浊的液体就是乳浊液。牛奶食用油(2)特点:不具备均一性和稳定性。 2.乳化现象 洗涤剂(如洗洁精)能使植物油在水中分散成无数细小的液滴,而不聚集成大的油珠,从而使油和水不再分层,所形成的乳浊液稳定性增强,这种现象称为乳化。提醒除污的原理及应用洗涤剂清洗油污汽油除油渍、用酒精洗去试管中的碘用稀盐酸除去铁锈、醋酸除水垢乳化溶解化学变化 (1)概念 在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做饱和溶液。还能继续溶解的溶液叫做不饱和溶液。溶解度饱和溶液 (1)饱和溶液不一定是浓溶液,如饱和石灰水溶液就是稀溶液;不饱和溶液不一定是稀溶液,如不饱和的氯化钠溶液可能是浓溶液。 (2)一定温度下,同种溶质的饱和溶液一定比不饱和溶液浓。特别提醒 (2)饱和溶液和不饱和溶液之间的转化及结晶的方法不饱和溶液增加溶质、蒸发溶剂、降低温度增加溶剂、升高温度饱和溶液饱和溶液注意:氢氧化钙等少量物质在一定量的水中溶解的最大量随温度的升高而降低,因此它们的不饱和溶液变为饱和溶液需要升高温度;饱和溶液变为不饱和溶液需要降低温度。蒸发溶剂冷却结晶 1.固体的溶解度 (1)概念:在一定______下,某固态物质在_____ g溶剂里达到_____状态时所溶解的质量。 (2)溶解度的含义 20 ℃时氯化钠的溶解度为36 g的含义:温度100饱和溶解度 在20 ℃时,在100 g水中最多能溶解36 g氯化钠,或在20 ℃时,氯化钠在100 g水中达到饱和状态时所溶解的质量为36 g。①内部因素:______和______本身的性质。②外部因素:温度。大多数固体物质的溶解度随温度升高而升高,如硝酸钾。少数固体物质的溶解度受温度的影响很小,如氯化钠。极少数固体物质的溶解度随温度的升高而减小,如氢氧化钙。溶质溶剂(3)影响因素溶解度的计算公式:(4)溶解度曲线 用纵坐标表示溶解度,横坐标表示温度,得到物质溶解度随温度变化的曲线,这种曲线叫溶解度曲线。氢氧化钙的溶解度曲线几种固体物质的溶解度曲线曲线a、b 分别为物质A、B的溶解度曲线观察A、B的溶解度曲线回答下列问题: ①曲线a、曲线b、N点、Р点、M点分别表示什么含义? ②可通过什么方法从溶液中提取物质A、B?试一试曲线a:物质A的溶解度随温度的升高而增大,受温度影响较大。曲线b:物质B的溶解度随温度的升高而缓慢增大,受温度影响较小。N点:物质A在T1时的溶解度为S1 g。P点:物质B在T2时的溶解度为S2 g。M点:在T3时物质A和物质B的溶解度相等,都为S3 g。可通过冷却热饱和溶液的方法从溶液中提取物质A。可通过蒸发溶剂的方法从溶液中提取物质B。 2.气体物质的溶解度 (1)概念:压强为101 kPa和一定温度时,在1体积水里溶解达到饱和状态时的气体体积。 (2)影响因素溶液的浓度 1.溶质的质量分数 (1)定义:溶液中溶质的质量分数是溶质质量与溶液质量之比。 (2)计算公式溶质质量=溶液质量×溶质的质量分数 2.溶液的稀释 (1)依据:溶液加溶剂稀释前后,溶质的质量不变。 (2)计算公式 ①浓溶液的质量×浓溶液的溶质质量分数=稀溶液的质量×稀溶液的溶质质量分数 ②稀溶液的质量=浓溶液的质量+水的质量探究一定溶质质量分数氯化钠溶液的配制实验用品实验步骤 托盘天平(带砝码)、药匙、量筒、胶头滴管、烧杯、玻璃棒、氯化钠、蒸馏水等。 1.用固体溶质配制一定溶质质量分数的溶液: 计算→称量(量取)→溶解。以配制50 g质量分数为6%的氯化钠溶液为例。 ①计算:所需氯化钠固体的质量为____ g,水的质量为____ g。 ②______:用托盘天平称量所需的氯化钠,倒入烧杯中,称量时若发现指针偏向右边,应向左盘中继续添加氯化钠。 ③量取:用______量取所需的水(水的密度可近似看做1 g/cm3),倒入盛有氯化钠的烧杯中。 ④溶解:用________不断搅拌,直至氯化钠全部溶解。347称量量筒玻璃棒 2.用已知质量分数的溶液配制一定溶质质量分数的溶液:计算→量取→混匀。 用已配制好的质量分数为6%的氯化钠溶液(密度为1.04 g /cm3)配制50 g质量分数为3%的氯化钠溶液。 ①计算:所需浓溶液的质量为____ g,水的质量为____ g。 ②量取:用_____量取浓溶液(接近所需体积时改用_________)和水。 ③混匀:将量取的浓溶液和水倒入烧杯中用玻璃棒搅拌。2525量筒胶头滴管 3.装瓶:把配制好的上述两种氯化钠溶液分别装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液中溶质的质量分数),放到试剂柜中。(1)造成溶质质量分数偏大的原因配制溶液中的误差分析称量固体溶质质量偏多量取溶剂时俯视读数向烧杯倾倒水时洒出(2)造成溶质质量分数偏小的原因称量固体时, 药品和砝码的位置颠倒,并使用了游码准确称量氯化钠固体后,转移或溶解时,有少量氯化钠固体洒出配制溶液的烧杯用水润湿氯化钠固体中含有杂质,不干燥或已潮解量取水时仰视读数
第九单元 溶液单元复习人教版化学九年级下册生理盐水、海水、面糊、泥水、牛奶、石灰乳、饮料、硫酸铜溶液请指出以上这些物质中有哪些属于溶液。 √√√√溶液的形成 1.概念:一种或几种物质分散到另一种物质里,形成______、______的混合物,叫做溶液。均一稳定 2.基本特征溶液 ①均一性;②稳定性;③混合物。 3.组成 ①溶剂:起溶解作用的物质。 ②溶质:被溶解的物质。 a.溶质可以是固体、液体或气体;固体溶于液体,固体为溶质,液体为溶剂;液体溶于液体,有水,水为溶剂,无水,量多的为溶剂。 b.溶液的质量=溶质的质量+溶剂的质量 溶液的体积<溶质的体积+溶剂的体积 注意溶解时的吸热或放热现象 3.当t1=t时,溶液的温度不变,溶解没有明显吸热、放热现象,如氯化钠溶于水。加入固体 1.当t1<t时,溶液的温度升高,溶解放热,如氢氧化钠溶于水、浓硫酸加入水中被稀释。 2.当t1>t时,溶液的温度降低,溶解吸热,如硝酸铵溶于水。乳化现象 1.乳浊液 (1)定义:小液滴分散到液体里形成的混合物。如:____、______等液体滴入到水中并用力振荡后形成的乳状浑浊的液体就是乳浊液。牛奶食用油(2)特点:不具备均一性和稳定性。 2.乳化现象 洗涤剂(如洗洁精)能使植物油在水中分散成无数细小的液滴,而不聚集成大的油珠,从而使油和水不再分层,所形成的乳浊液稳定性增强,这种现象称为乳化。提醒除污的原理及应用洗涤剂清洗油污汽油除油渍、用酒精洗去试管中的碘用稀盐酸除去铁锈、醋酸除水垢乳化溶解化学变化 (1)概念 在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做饱和溶液。还能继续溶解的溶液叫做不饱和溶液。溶解度饱和溶液 (1)饱和溶液不一定是浓溶液,如饱和石灰水溶液就是稀溶液;不饱和溶液不一定是稀溶液,如不饱和的氯化钠溶液可能是浓溶液。 (2)一定温度下,同种溶质的饱和溶液一定比不饱和溶液浓。特别提醒 (2)饱和溶液和不饱和溶液之间的转化及结晶的方法不饱和溶液增加溶质、蒸发溶剂、降低温度增加溶剂、升高温度饱和溶液饱和溶液注意:氢氧化钙等少量物质在一定量的水中溶解的最大量随温度的升高而降低,因此它们的不饱和溶液变为饱和溶液需要升高温度;饱和溶液变为不饱和溶液需要降低温度。蒸发溶剂冷却结晶 1.固体的溶解度 (1)概念:在一定______下,某固态物质在_____ g溶剂里达到_____状态时所溶解的质量。 (2)溶解度的含义 20 ℃时氯化钠的溶解度为36 g的含义:温度100饱和溶解度 在20 ℃时,在100 g水中最多能溶解36 g氯化钠,或在20 ℃时,氯化钠在100 g水中达到饱和状态时所溶解的质量为36 g。①内部因素:______和______本身的性质。②外部因素:温度。大多数固体物质的溶解度随温度升高而升高,如硝酸钾。少数固体物质的溶解度受温度的影响很小,如氯化钠。极少数固体物质的溶解度随温度的升高而减小,如氢氧化钙。溶质溶剂(3)影响因素溶解度的计算公式:(4)溶解度曲线 用纵坐标表示溶解度,横坐标表示温度,得到物质溶解度随温度变化的曲线,这种曲线叫溶解度曲线。氢氧化钙的溶解度曲线几种固体物质的溶解度曲线曲线a、b 分别为物质A、B的溶解度曲线观察A、B的溶解度曲线回答下列问题: ①曲线a、曲线b、N点、Р点、M点分别表示什么含义? ②可通过什么方法从溶液中提取物质A、B?试一试曲线a:物质A的溶解度随温度的升高而增大,受温度影响较大。曲线b:物质B的溶解度随温度的升高而缓慢增大,受温度影响较小。N点:物质A在T1时的溶解度为S1 g。P点:物质B在T2时的溶解度为S2 g。M点:在T3时物质A和物质B的溶解度相等,都为S3 g。可通过冷却热饱和溶液的方法从溶液中提取物质A。可通过蒸发溶剂的方法从溶液中提取物质B。 2.气体物质的溶解度 (1)概念:压强为101 kPa和一定温度时,在1体积水里溶解达到饱和状态时的气体体积。 (2)影响因素溶液的浓度 1.溶质的质量分数 (1)定义:溶液中溶质的质量分数是溶质质量与溶液质量之比。 (2)计算公式溶质质量=溶液质量×溶质的质量分数 2.溶液的稀释 (1)依据:溶液加溶剂稀释前后,溶质的质量不变。 (2)计算公式 ①浓溶液的质量×浓溶液的溶质质量分数=稀溶液的质量×稀溶液的溶质质量分数 ②稀溶液的质量=浓溶液的质量+水的质量探究一定溶质质量分数氯化钠溶液的配制实验用品实验步骤 托盘天平(带砝码)、药匙、量筒、胶头滴管、烧杯、玻璃棒、氯化钠、蒸馏水等。 1.用固体溶质配制一定溶质质量分数的溶液: 计算→称量(量取)→溶解。以配制50 g质量分数为6%的氯化钠溶液为例。 ①计算:所需氯化钠固体的质量为____ g,水的质量为____ g。 ②______:用托盘天平称量所需的氯化钠,倒入烧杯中,称量时若发现指针偏向右边,应向左盘中继续添加氯化钠。 ③量取:用______量取所需的水(水的密度可近似看做1 g/cm3),倒入盛有氯化钠的烧杯中。 ④溶解:用________不断搅拌,直至氯化钠全部溶解。347称量量筒玻璃棒 2.用已知质量分数的溶液配制一定溶质质量分数的溶液:计算→量取→混匀。 用已配制好的质量分数为6%的氯化钠溶液(密度为1.04 g /cm3)配制50 g质量分数为3%的氯化钠溶液。 ①计算:所需浓溶液的质量为____ g,水的质量为____ g。 ②量取:用_____量取浓溶液(接近所需体积时改用_________)和水。 ③混匀:将量取的浓溶液和水倒入烧杯中用玻璃棒搅拌。2525量筒胶头滴管 3.装瓶:把配制好的上述两种氯化钠溶液分别装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液中溶质的质量分数),放到试剂柜中。(1)造成溶质质量分数偏大的原因配制溶液中的误差分析称量固体溶质质量偏多量取溶剂时俯视读数向烧杯倾倒水时洒出(2)造成溶质质量分数偏小的原因称量固体时, 药品和砝码的位置颠倒,并使用了游码准确称量氯化钠固体后,转移或溶解时,有少量氯化钠固体洒出配制溶液的烧杯用水润湿氯化钠固体中含有杂质,不干燥或已潮解量取水时仰视读数
相关资料
更多









