




2024九年级化学上册第1章物质及其变化第3节常见的酸第2课时硫酸与酸的通性习题课件浙教版
展开
这是一份2024九年级化学上册第1章物质及其变化第3节常见的酸第2课时硫酸与酸的通性习题课件浙教版,共20页。
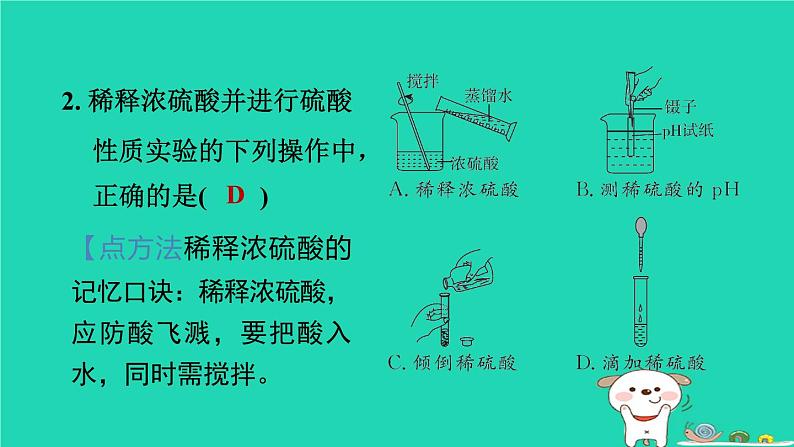
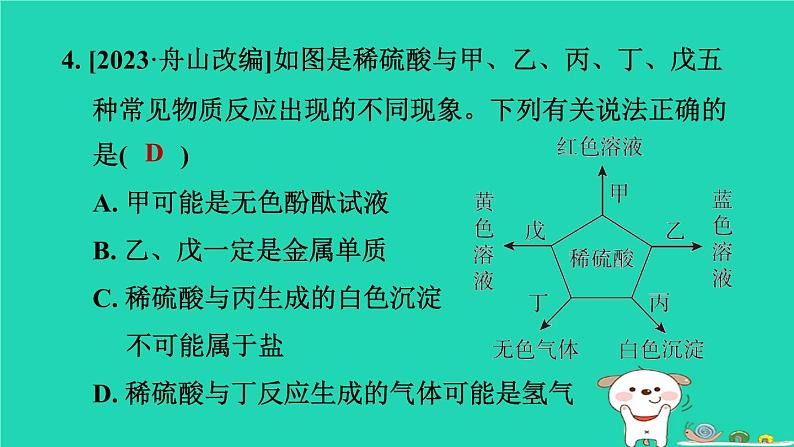
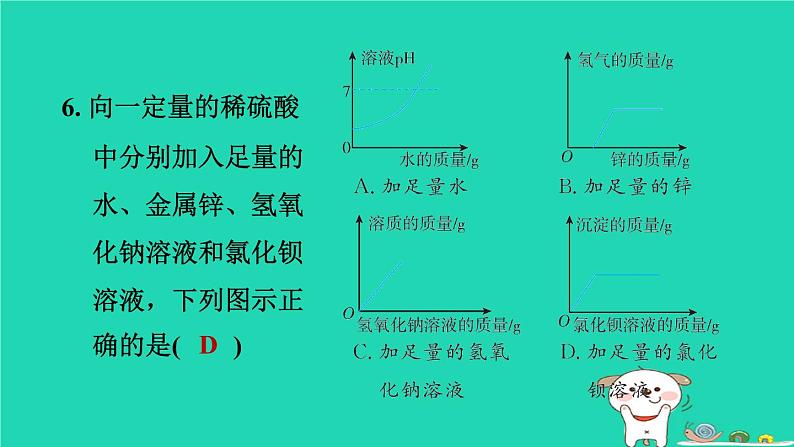
浙教版九年级上册第1章 物质及其变化1.3.2 硫酸与酸的通性1. 下列有关酸的性质的说法正确的是( )A. 浓盐酸和浓硫酸盛放在敞口容器中,溶液质量都会减小B. 浓盐酸、浓硫酸都能使纸张炭化 C. 浓盐酸、浓硫酸都可用来干燥二氧化碳气体D. 稀盐酸和稀硫酸都可用于除铁锈D2. 稀释浓硫酸并进行硫酸性质实验的下列操作中,正确的是( )【点方法稀释浓硫酸的记忆口诀:稀释浓硫酸,应防酸飞溅,要把酸入水,同时需搅拌。D3. 硫酸是一种常见的酸。下列关于硫酸的说法中,正确的是( )A. 组成:硫酸中含有H+和SO42-两种微粒,且数目相同 B. 性质:能与碱、活泼金属及CO2、SO3等非金属氧化物反应 C. 用途:可用于清除铁表面的氧化铁和生产化肥硫酸铵 D. 检验:滴入氯化钡溶液,产生白色沉淀,滴加稀硝酸,沉淀不溶解C4. [2023·舟山改编]如图是稀硫酸与甲、乙、丙、丁、戊五种常见物质反应出现的不同现象。下列有关说法正确的是( ) A. 甲可能是无色酚酞试液B. 乙、戊一定是金属单质C. 稀硫酸与丙生成的白色沉淀 不可能属于盐D. 稀硫酸与丁反应生成的气体可能是氢气D【点拨】稀硫酸不能使无色酚酞试液变红,A错误;含有铜离子的溶液是蓝色的,含有铁离子的溶液是黄色的,铜是一种不活泼金属,不能与稀硫酸反应,铁与稀硫酸反应生成硫酸亚铁和氢气,硫酸亚铁溶液是浅绿色的,B错误;稀硫酸与丙生成的白色沉淀可能属于盐,如稀硫酸与氯化钡反应生成硫酸钡白色沉淀(一种盐)和盐酸,C错误;稀硫酸与丁反应生成的气体可能是氢气,如稀硫酸与锌反应生成硫酸锌和氢气,D正确。5. [2022·杭州一模]酒石酸(C4H6O6)是葡萄酒中主要的有机酸之一,在水溶液中可以电离出H+,从而呈现酸性,主要用作饮料添加剂或药物工业原料。下列物质不能与酒石酸反应的是( )A. CO2 B. AL2O3 C. KOH D. Fe【点拨】本题考查酸的通性。金属氧化物AL2O3、碱KOH、活泼金属Fe均能与酸反应,非金属氧化物CO2不能与酸反应,故A符合题意。 A6. 向一定量的稀硫酸中分别加入足量的水、金属锌、氢氧化钠溶液和氯化钡溶液,下列图示正确的是( )D【点拨】A项,向一定量的稀硫酸中加入足量水,溶液的酸性减弱,但溶液始终显酸性,PH不可能大于或等于7,故该图像错误;B项,锌和硫酸反应立即产生氢气,所以起点应该从0开始,故该图像错误;C项,硫酸和氢氧化钠反应生成硫酸钠和水,反应前,溶液中的溶质是硫酸,所以溶质质量的起点不为0,随着反应的进行,溶质质量逐渐增大,完全反应后,继续加入氢氧化钠溶液,溶质质量增大的幅度减小,故该图像错误;D项,硫酸和氯化钡反应生成硫酸钡沉淀和盐酸,随着反应的进行,生成沉淀的质量逐渐增大,至完全反应后不再发生改变,故该图像正确。7. 稀硫酸是实验室中一种重要的试剂,用途十分广泛。小叶向盛有稀硫酸的烧杯中加入适量的某种固体,反应前后,烧杯内溶液中的主要离子种类及个数比变化如图所示(不考虑微粒大小)。加入的固体不可能是( )A. 铁 B. 铝C. 氧化铜 D. 氢氧化镁B【点拨】加入的固体不可能是铝,因为铝与硫酸反应生成硫酸铝和氢气,硫酸铝[AL2(SO4)3]中铝离子与硫酸根离子的个数比为2 : 3,而题图中反应后两种离子的个数比为1∶1。8. [2023·舟山改编]小舟用锌粒和稀硫酸在实验室制取一瓶干燥的氢气。 Zn+H2SO4=== ZnSO4+H2↑根据反应条件与反应物状态,小舟应选择的发生装置是______(填“甲”或“乙”)。乙为了得到干燥的氢气,小舟设计了如图丙所示的收集装置,装置中液体a可以是________。用温度计的液泡蘸取少量液体a,放置在空气中一会儿,可观察到温度计的示数变大,其原因是_____________________________________________________________________。浓硫酸浓硫酸具有吸水性,能吸收空气中的水蒸气,浓硫酸溶于水放热9. [2024·台州期末改编]中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0. 25 g/L。 某兴趣小组用如图所示装置(夹持装置略)收集某葡萄酒中的SO2,并用碱对其含量进行测定。(1)仪器A的名称是________,水通入A中的进口为________(填“a”或“b”)。冷凝管b(2)实验开始前要检查装置的气密性,写出检查气密性的方法:____________________________________________________________________________________________________________________________________________________________。向锥形瓶中加入少量水浸没导管口,微热(或用手捂)烧瓶,导管口有气泡冒出,冷却(或松开手)后,水倒吸入导管中形成一段水柱,说明气密性良好(3)向B中加入1 000 mL 该葡萄酒和适量盐酸,加热,SO2全部逸出并与C中的100 mL H2O2 溶液完全反应(化学方程式为SO2+H2O2===H2SO4),向C中滴加几滴BaCl2溶液,产生白色沉淀,写出反应的化学方程式:____________________________________。BaCl2+H2SO4===BaSO4↓+2HCl(4)除去C中过量的 H2O2 ,然后用密度为 1. 0 g/mL、溶质质量分数为0. 2%的 NaOH溶液进行酸碱中和滴定反应(H2SO4和NaOH恰好完全反应),滴定至反应完全时消耗 NaOH溶液100 mL,计算该葡萄酒中 SO2的含量为________g/L。0. 16(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:___________________________________________________________________________。原因:盐酸的挥发;改进措施:用不挥发的强酸(如硫酸)代替盐酸进行实验【点拨】(5)由于盐酸是挥发性酸,进入C装置的气体除了SO2外还有HCL,HCL也能与氢氧化钠反应,从而使消耗的氢氧化钠溶液的体积增加,导致测定结果偏高。因此改进的措施为用不挥发的强酸(如硫酸)代替盐酸进行实验。






