




- 人教版 (新课标)选修4 化学反应原理 2.2 影响化学反应速率的因素(第1课时 有效碰撞理论 浓度、压强对化学反应速率的影响) 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 2.2 影响化学反应速率的因素(第1课时 有效碰撞理论 浓度、压强对化学反应速率的影响) 课后练习 试卷 0 次下载
- 人教版 (新课标)选修4 化学反应原理 2.2 影响化学反应速率的因素(第2课时 温度、催化剂对化学反应速率的影响) 课后练习 试卷 0 次下载
- 人教版 (新课标)选修4 化学反应原理 2.3 化学平衡 (第1课时 化学平衡状态) 课后练习 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 2.3 化学平衡 (第1课时 化学平衡状态) 课件 课件 0 次下载
化学选修4 化学反应原理第二节 影响化学反应速率的因素试讲课课件ppt
展开【复习回顾】阐述浓度增大、压强增大对化学反应速率的影响。
当浓度增大时→单位体积内活化分子增多→单位时间、单位体积内的有效碰撞次数增多→反应速率加快。
当压强增大(缩小体积或增加反应物)时→单位体积分子数增加(即增大浓度)→单位体积内的活化分子增多→单位时间、单位体积内的有效碰撞次数增多→反应速率加快。
第二节 影响化学反应速率的因素(第2课时 温度、催化剂对化学反应速率的影响)
第二章 化学反应速率与化学平衡
三、温度对化学反应速率的影响(实验2-3)
1. 温度与化学反应速率的关系(实验2-3)
Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
【规律】其他条件不变,升高温度,化学反应速率加快。
【原因】(1)浓度一定时,升高温度,分子的能量增加,活化分子百分数增加,反应速率增大。
(2)温度升高,使分子运动的速度加快,单位时间内反应物分子间的碰撞次数增加,反应速率也会相应的加快。
(2)一般,温度每升高10℃,化学反应速率增大2~4倍。
【规律】反应若是可逆反应,升高温度,正、逆反应速率都加快,降低温度,正、逆反应速率都减小。
2.温度影响化学反应速率的原因(理论)
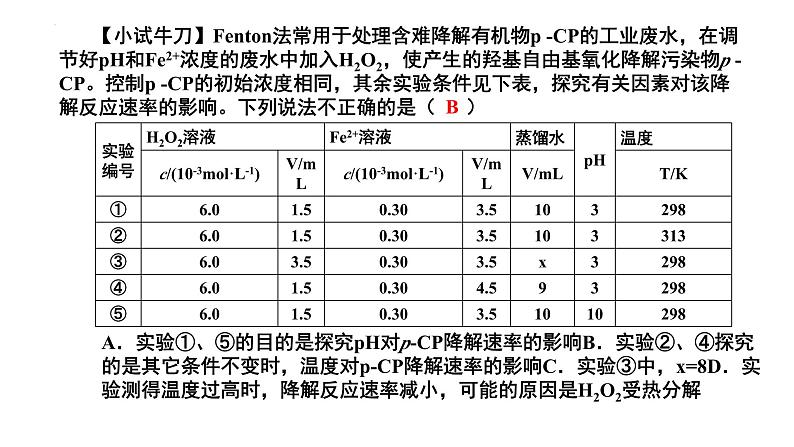
【小试牛刀】Fentn法常用于处理含难降解有机物p -CP的工业废水,在调节好pH和Fe2+浓度的废水中加入H2O2,使产生的羟基自由基氧化降解污染物p -CP。控制p -CP的初始浓度相同,其余实验条件见下表,探究有关因素对该降解反应速率的影响。下列说法不正确的是( )
A.实验①、⑤的目的是探究pH对p-CP降解速率的影响B.实验②、④探究的是其它条件不变时,温度对p-CP降解速率的影响C.实验③中,x=8D.实验测得温度过高时,降解反应速率减小,可能的原因是H2O2受热分解
四、催化剂对化学反应速率的影响
【规律】适当的催化剂能加快化学反应速率。
【注意】加快化学反应速率的催化剂叫正催化剂 减慢化学反应速率的催化剂叫负催化剂(抑制剂) 如无特殊说明,凡是说催化剂都是指正催化剂
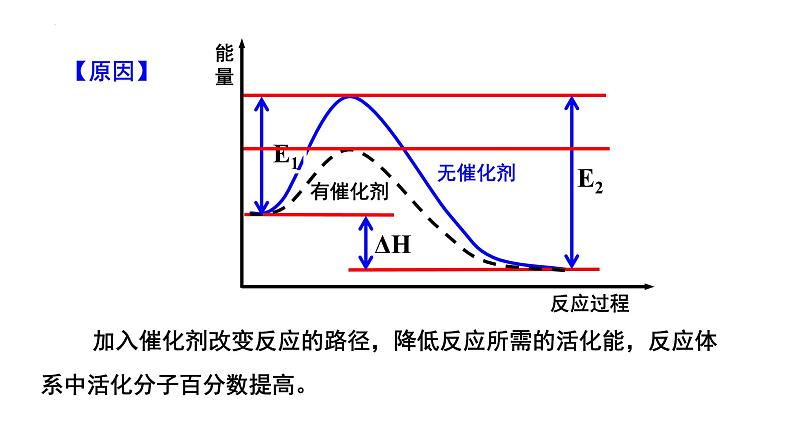
【原因】催化剂能够降低反应所需的能量→更多的反应物分子成为活化分子→活化分子百分比增大→有效碰撞次数增多→ 加快反应速率。
加入催化剂改变反应的路径,降低反应所需的活化能,反应体系中活化分子百分数提高。
(1)催化剂只能改变反应速率,不能改变反应方向,反应热没变。
(2)对于可逆反应,同一催化剂能同等程度的改变正、逆化学反应的速率。
(3)催化剂有一定的选择性和活化温度。
【小试牛刀】2021年10月6日诺贝尔化学奖揭晓,科学家David MacMillan和Benjamin List因在“不对称有机催化”研究方面的进展被授予该奖项。催化剂可改变化学反应的历程(如图所示),下列说法正确的是( )
A.图中ΔH=E1-E2,ΔH<0B.升高温度,催化剂的活性一定增强C.相比曲线a,曲线b是使用了催化剂的反应历程D.图中反应物的键能总和大于生成物的键能总和
五、其他因素对化学反应速率的影响
如反应物颗粒的大小、溶剂的性质、光、超声波、磁场等
【小试牛刀】盐酸与块状CaCO3反应时,不能使反应最初的速率明显加快的是( ) A.将盐酸的用量增加一倍 B.盐酸的浓度增加一倍,用量减半 C.温度升高30 ℃ D.将块状CaCO3粉碎后再与盐酸反应
影响化学反应速率的因素
外因对速率影响的有效碰撞理论解释
【小试牛刀】(双选)将一定浓度的盐酸倒入碳酸钙中,若作如下改变的情况,其中能使最初的化学反应速率增大的是( ) A、盐酸的浓度不变,而使盐酸的用量一倍 B、盐酸的浓度增大一倍,而使盐酸的用量减少到原来的一半 C、盐酸的浓度和用量都不变,增加碳酸钙的量 D、盐酸和碳酸钙不变,增大压强一倍 E、加入CaCl2溶液 F、加入CaCl2固体 G、将CaCO3用CaCO3粉末代替
外界条件对化学反应速率的影响
1、在下列事实中,什么因素影响了化学反应的速率? (1)夏天的食物易霉变,冬天就不易发生该现象。 (2)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体。 (3)工业上常将固体燃料粉碎,以提高燃烧效率。 (4)同体积同浓度的硫酸溶液和盐酸溶液与同样大小且质量相同的锌粒反应,产生气体有快有慢。 (5)集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸。 (6)浓硝酸常盛放在棕色瓶里,且放在黑暗处和温度低的地方。
2、硫代硫酸钠( Na2S2O3)与稀硫酸发生如下反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列四种情况中最早出现浑浊的是( ) A、10℃时0.1 ml /L Na2S2O3和0.1 ml /L H2SO4各 5 mL B、10℃时0.1 ml /L Na2S2O3和0.1 ml /L H2SO4各5 mL,加水10mL C、20℃ 时0.1 ml /LNa2S2O3和0.1 ml /L H2SO4各 5 mL D、20℃ 时0.2ml /L Na2S2O3和0.1 ml /L H2SO4各5 mL,加水10 mL
化学第三节 化学平衡精品ppt课件: 这是一份化学<a href="/hx/tb_c22166_t3/?tag_id=26" target="_blank">第三节 化学平衡精品ppt课件</a>,文件包含23化学平衡第3课时影响化学平衡的因素-温度催化剂原卷版docx、23化学平衡第3课时影响化学平衡的因素-温度催化剂解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第三节 化学平衡精品ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理<a href="/hx/tb_c22166_t3/?tag_id=26" target="_blank">第三节 化学平衡精品ppt课件</a>,共20页。PPT课件主要包含了复习巩固,不移动,逆反应,平衡向逆反应方向移动,平衡向正反应方向移动,实验结论,速率解释,v”正=v”逆,v’逆,v’正等内容,欢迎下载使用。
高中化学第二章 化学反应速率和化学平衡第二节 影响化学反应速率的因素优质课件ppt: 这是一份高中化学<a href="/hx/tb_c22165_t3/?tag_id=26" target="_blank">第二章 化学反应速率和化学平衡第二节 影响化学反应速率的因素优质课件ppt</a>,共21页。PPT课件主要包含了催化剂等内容,欢迎下载使用。













