





还剩31页未读,
继续阅读
人教版九下化学第九单元课时2溶质质量分数的综合计算课件
展开
这是一份人教版九下化学第九单元课时2溶质质量分数的综合计算课件,共39页。
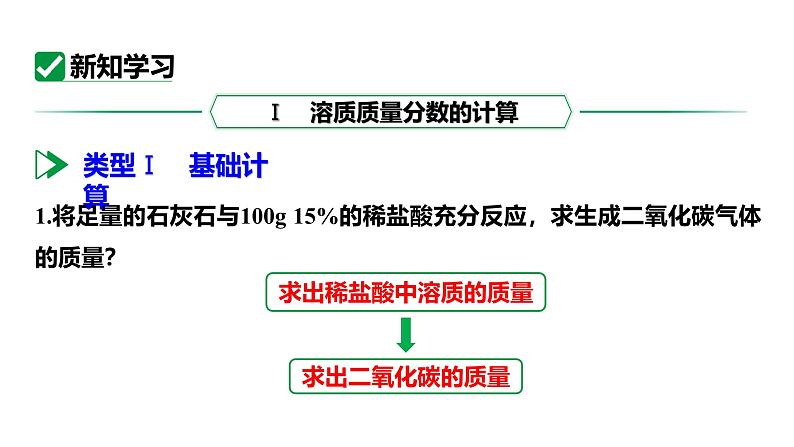
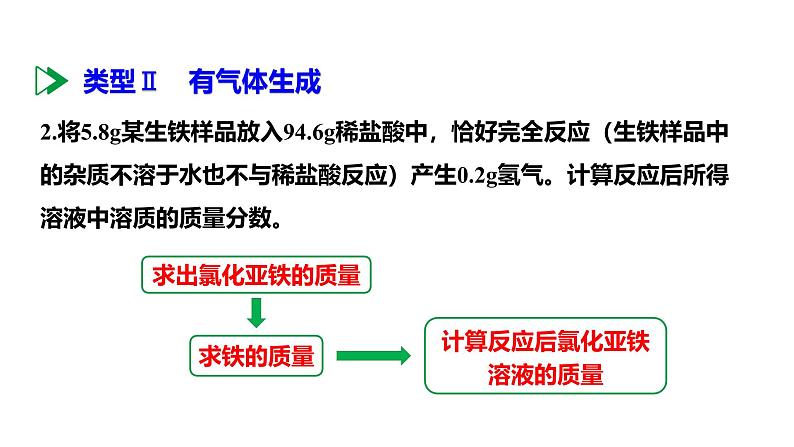
课时2 溶质质量分数的综合计算学习目标新课引入新知学习课堂小结1.进一步熟练有关溶质质量分数的计算2.掌握配制一定溶质质量分数溶液的操作方法3.掌握溶质的质量分数与化学方程式的综合计算1.溶质的质量分数:2.溶质的质量和溶剂的质量的计算:溶质的质量 = 溶液的质量 × 溶质的质量分数溶剂的质量 = 溶液的质量 + 溶质的质量1.将足量的石灰石与100g 15%的稀盐酸充分反应,求生成二氧化碳气体的质量?求出二氧化碳的质量求出稀盐酸中溶质的质量1.将足量的石灰石与100g 15%的稀盐酸充分反应,求生成二氧化碳气体的质量?答:生成二氧化碳气体的质量约为9.04g。设生成二氧化碳的质量为x。 73 44 15g xx ≈ 9.04g解:100g 15%的稀盐酸中氯化氢的质量为100g×15%=15g 在溶液中发生化学反应时,参加反应的是溶液中的溶质。所以利用化学方程式列有关反应物、生成物的质量比时,要用溶质的质量列比例,而不能用溶液的质量或体积列比例。2.将5.8g某生铁样品放入94.6g稀盐酸中,恰好完全反应(生铁样品中的杂质不溶于水也不与稀盐酸反应)产生0.2g氢气。计算反应后所得溶液中溶质的质量分数。求铁的质量求出氯化亚铁的质量计算反应后氯化亚铁溶液的质量2.将5.8g某生铁样品放入94.6g稀盐酸中,恰好完全反应(生铁样品中的杂质不溶于水也不与稀盐酸反应)产生0.2g氢气。计算反应后所得溶液中溶质的质量分数。解:设5.8g生铁样品中铁的质量为x,反应生成氯化亚铁的质量为y。Fe + 2HCl FeCl2 + H2↑56 127 2 x y 0.2g反应后所得氯化亚铁溶液的质量为: 5.6g + 94.6g - 0.2g = 100g 反应后所得氯化亚铁溶液中溶质的质量分数为:答:反应后所得氯化亚铁溶液中溶质的质量分数为12.7%。1. 溶液组成法:溶液质量 = 溶质质量 + 溶剂质量。有些反应不生成(或不消耗)水,溶剂(水)的质量等于参加反应的各溶液中溶剂质量之和;若反应后有水生成(或反应中消耗了水),则还需要加上(或减去)生成(或消耗)水的质量。求反应后所得溶液的质量的两种方法2. 质量守恒法:反应后所得溶液的质量 = 反应物的质量总和 - 生成气体的质量 - 生成沉淀的质量。3.为测定某工厂排放的废水中氢氧化钠的含量,兴趣小组将100g该废水与50g硫酸铜溶液混合恰好完全反应,得到4.9g沉淀。请计算该废水中氢氧化钠的质量分数。【提示:CuSO4+2NaOH ===== Na2SO4+Cu(OH)2↓】求出氢氧化钠的质量计算废水中氢氧化钠质量分数 80 98 x 4.9 g答:废水中氢氧化钠的质量分数为4%。解:设参加反应氢氧化钠的质量为x。CuSO4+2NaOH ===== Na2SO4+Cu(OH)2↓3.为测定某工厂排放的废水中氢氧化钠的含量,兴趣小组将100g该废水与50g硫酸铜溶液混合恰好完全反应,得到4.9g沉淀。请计算该废水中氢氧化钠的质量分数。【提示:CuSO4+2NaOH ===== Na2SO4+Cu(OH)2↓】4.实验室用34g过氧化氢溶液和1g二氧化锰制取氧气,实验的相关数据如图。请回答:(1)反应生成氧气的质量为______g。(2)计算过氧化氢溶液中溶质的质量分数。1.6求生成氧气的质量求过氧化氢的质量求溶质的质量分数(2)计算过氧化氢溶液中溶质的质量分数。解:设34g过氧化氢溶液中过氧化氢的质量为x。2H2O2 ===== 2H2O+O2↑答:过氧化氢溶液中溶质的质量分数为10%。68 32 x 1.6g 某实验小组的同学为了测定石灰石样品中碳酸钙的质量分数,取12.5g该样品放入烧杯中,加入94.4g一定质量分数的稀盐酸。恰好完全反应后烧杯中物质的质量为102.5g(不含烧杯质量)。(说明:杂质既不溶于水也不参与反应)求:(1)生成气体的质量。 (2)反应后所得溶液中溶质的质量分数。CaCO3 + 2HCl ===== CaCl2 + H2O + CO2 ↑(2)解:设碳酸钙的质量为x,生成的氯化钙质量为y。100 111 44 x y 4.4g(1)生成二氧化碳的质量为12.5g + 94.4g - 102.5g = 4.4g。反应后所得溶液的质量为102.5g- (12.5g - 10g) = 100g溶液中溶质的质量分数为 ×100%=11.1%答:反应后所得溶液中溶质的质量分数为11.1% 。 生活中有各种各样的溶液,很多溶液的溶质质量分数是一定的,如输液用的生理盐水。那么如何配制一定溶质质量分数的溶液呢?【仪器】氯化钠、蒸馏水。【药品】1. 计算: NaCl g H2O g。2. 称量:用__________称量3g食盐,放入烧杯中。3. 量取:用_____量取47mL水(水的密度可近似看做1g/cm3),倒入盛有氯化钠的烧杯中。347托盘天平量筒4.溶解:用玻璃棒搅拌,使氯化钠溶解。整个配制过程如下图所示。用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。1.计算:配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液和水的质量分别为:6%的氯化钠溶液 g(体积 mL);水 g。2525242.量取:用量筒量取24mL的6%氯化钠溶液和25mL的水,倒入烧杯中。3.混匀:用玻璃棒搅拌,使溶液混合均匀。 最后,把配制好的上述两种氯化钠溶液分别装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液中溶质的质量分数),放到试剂柜中。一定溶质质量分数的氯化钠溶液的配制用天平称量药品时,应遵循“左物右码”的原则。如果实验中药品和砝码放反了,最终配制溶液的溶质质量分数会偏大还是偏小?配制一定溶质质量分数溶液的误差分析溶质质量增大或溶剂质量减小溶质质量减小或溶剂质量增大溶质质量分数偏大溶质质量分数偏小偏小偏小偏小偏小偏小偏小不变不变不变不变不变不变不变不变偏大偏大偏大偏大偏大偏小不变偏大同比例减小不变不变不变偏小偏大偏小偏大偏大不变偏小不变偏小1. 要配制100g溶质质量分数为10%的氯化钠溶液,下列操作正确的是( )A.将10g氯化钠固体直接放在天平的托盘上称量B.量取90mL水时,俯视读数C.为加快固体溶解,用温度计搅拌溶液D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签D×平视玻璃棒溶质质量分数的综合计算计算 → 称量 → 量取 → 溶解步骤:①写出化学方程式; ②根据化学方程式计算溶质质量; ③计算溶质的质量分数配制一定溶质质量分数的溶液1.小明用石灰石测定某稀盐酸中溶质的质量分数。向盛有100g稀盐酸的烧杯中依次加入石灰石粉末(杂质不参加反应),充分反应后,记录实验数据见下表。请计算:(1)共生成二氧化碳_____g。 (2)所用稀盐酸中溶质的质量分数。8.8解析:根据质量守恒定律,分析题表数据可知,共生成二氧化碳的质量为100g+15g+15g-121.2g=8.8g。(2)解:设100g稀盐酸中溶质的质量为x。答:所用稀盐酸中溶质的质量分数为14.6%。 73 44 x 8.8g所用稀盐酸中溶质的质量分数为2. 实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法正确的是( )A.托盘天平未经调零即用来称取氯化钠固体B.称量时托盘天平指针偏左,移动游码至天平平衡C.量取水时,用规格为50mL的量筒D.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,会使氯化钠溶液的溶质质量分数偏大C解析:托盘天平使用前要先通过调节平衡螺母调节天平平衡;称量时托盘天平指针偏左,应减少左盘中的药品;经计算所需氯化钠固体质量为 50g×15% = 7.5g,所需水的质量为 50g-7.5g = 42.5g,即42.5毫升;把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,会使氯化钠溶液的溶质的质量分数偏小。3. 配制一定溶质质量分数氯化钠溶液的过程如图所示: (1)写出图中标号a仪器的名称:______。 (2)配制50g质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠_____g,水______g。 (3)称量氯化钠时,氯化钠应放在托盘天平的____盘(填“左”或“右”)。量筒7.542.5左(2)氯化钠的质量为50g×15% = 7.5g;水的质量为50g-7.5g=42.5g。(4)把50g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是______g。100解析:(4)把50g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,根据稀释前后溶质质量不变,两溶液的差即为需要水的质量: 。 3. 配制一定溶质质量分数氯化钠溶液的过程如图所示: 在约500 mL的饮料瓶中加入2勺白糖和适量果汁,加入约1.5g 小苏打(碳酸氢钠),注入凉开水,再加入约1.5g 柠檬酸,立即旋紧瓶盖,摇匀,放入冰箱。半小时后,你就可以喝到清凉甘甜的汽水了。(注意:自制汽水时应使用食品级的碳酸氢钠和柠檬酸。)自制汽水对应巩固练习见《基础题与中考新考法》
课时2 溶质质量分数的综合计算学习目标新课引入新知学习课堂小结1.进一步熟练有关溶质质量分数的计算2.掌握配制一定溶质质量分数溶液的操作方法3.掌握溶质的质量分数与化学方程式的综合计算1.溶质的质量分数:2.溶质的质量和溶剂的质量的计算:溶质的质量 = 溶液的质量 × 溶质的质量分数溶剂的质量 = 溶液的质量 + 溶质的质量1.将足量的石灰石与100g 15%的稀盐酸充分反应,求生成二氧化碳气体的质量?求出二氧化碳的质量求出稀盐酸中溶质的质量1.将足量的石灰石与100g 15%的稀盐酸充分反应,求生成二氧化碳气体的质量?答:生成二氧化碳气体的质量约为9.04g。设生成二氧化碳的质量为x。 73 44 15g xx ≈ 9.04g解:100g 15%的稀盐酸中氯化氢的质量为100g×15%=15g 在溶液中发生化学反应时,参加反应的是溶液中的溶质。所以利用化学方程式列有关反应物、生成物的质量比时,要用溶质的质量列比例,而不能用溶液的质量或体积列比例。2.将5.8g某生铁样品放入94.6g稀盐酸中,恰好完全反应(生铁样品中的杂质不溶于水也不与稀盐酸反应)产生0.2g氢气。计算反应后所得溶液中溶质的质量分数。求铁的质量求出氯化亚铁的质量计算反应后氯化亚铁溶液的质量2.将5.8g某生铁样品放入94.6g稀盐酸中,恰好完全反应(生铁样品中的杂质不溶于水也不与稀盐酸反应)产生0.2g氢气。计算反应后所得溶液中溶质的质量分数。解:设5.8g生铁样品中铁的质量为x,反应生成氯化亚铁的质量为y。Fe + 2HCl FeCl2 + H2↑56 127 2 x y 0.2g反应后所得氯化亚铁溶液的质量为: 5.6g + 94.6g - 0.2g = 100g 反应后所得氯化亚铁溶液中溶质的质量分数为:答:反应后所得氯化亚铁溶液中溶质的质量分数为12.7%。1. 溶液组成法:溶液质量 = 溶质质量 + 溶剂质量。有些反应不生成(或不消耗)水,溶剂(水)的质量等于参加反应的各溶液中溶剂质量之和;若反应后有水生成(或反应中消耗了水),则还需要加上(或减去)生成(或消耗)水的质量。求反应后所得溶液的质量的两种方法2. 质量守恒法:反应后所得溶液的质量 = 反应物的质量总和 - 生成气体的质量 - 生成沉淀的质量。3.为测定某工厂排放的废水中氢氧化钠的含量,兴趣小组将100g该废水与50g硫酸铜溶液混合恰好完全反应,得到4.9g沉淀。请计算该废水中氢氧化钠的质量分数。【提示:CuSO4+2NaOH ===== Na2SO4+Cu(OH)2↓】求出氢氧化钠的质量计算废水中氢氧化钠质量分数 80 98 x 4.9 g答:废水中氢氧化钠的质量分数为4%。解:设参加反应氢氧化钠的质量为x。CuSO4+2NaOH ===== Na2SO4+Cu(OH)2↓3.为测定某工厂排放的废水中氢氧化钠的含量,兴趣小组将100g该废水与50g硫酸铜溶液混合恰好完全反应,得到4.9g沉淀。请计算该废水中氢氧化钠的质量分数。【提示:CuSO4+2NaOH ===== Na2SO4+Cu(OH)2↓】4.实验室用34g过氧化氢溶液和1g二氧化锰制取氧气,实验的相关数据如图。请回答:(1)反应生成氧气的质量为______g。(2)计算过氧化氢溶液中溶质的质量分数。1.6求生成氧气的质量求过氧化氢的质量求溶质的质量分数(2)计算过氧化氢溶液中溶质的质量分数。解:设34g过氧化氢溶液中过氧化氢的质量为x。2H2O2 ===== 2H2O+O2↑答:过氧化氢溶液中溶质的质量分数为10%。68 32 x 1.6g 某实验小组的同学为了测定石灰石样品中碳酸钙的质量分数,取12.5g该样品放入烧杯中,加入94.4g一定质量分数的稀盐酸。恰好完全反应后烧杯中物质的质量为102.5g(不含烧杯质量)。(说明:杂质既不溶于水也不参与反应)求:(1)生成气体的质量。 (2)反应后所得溶液中溶质的质量分数。CaCO3 + 2HCl ===== CaCl2 + H2O + CO2 ↑(2)解:设碳酸钙的质量为x,生成的氯化钙质量为y。100 111 44 x y 4.4g(1)生成二氧化碳的质量为12.5g + 94.4g - 102.5g = 4.4g。反应后所得溶液的质量为102.5g- (12.5g - 10g) = 100g溶液中溶质的质量分数为 ×100%=11.1%答:反应后所得溶液中溶质的质量分数为11.1% 。 生活中有各种各样的溶液,很多溶液的溶质质量分数是一定的,如输液用的生理盐水。那么如何配制一定溶质质量分数的溶液呢?【仪器】氯化钠、蒸馏水。【药品】1. 计算: NaCl g H2O g。2. 称量:用__________称量3g食盐,放入烧杯中。3. 量取:用_____量取47mL水(水的密度可近似看做1g/cm3),倒入盛有氯化钠的烧杯中。347托盘天平量筒4.溶解:用玻璃棒搅拌,使氯化钠溶解。整个配制过程如下图所示。用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。1.计算:配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液和水的质量分别为:6%的氯化钠溶液 g(体积 mL);水 g。2525242.量取:用量筒量取24mL的6%氯化钠溶液和25mL的水,倒入烧杯中。3.混匀:用玻璃棒搅拌,使溶液混合均匀。 最后,把配制好的上述两种氯化钠溶液分别装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液中溶质的质量分数),放到试剂柜中。一定溶质质量分数的氯化钠溶液的配制用天平称量药品时,应遵循“左物右码”的原则。如果实验中药品和砝码放反了,最终配制溶液的溶质质量分数会偏大还是偏小?配制一定溶质质量分数溶液的误差分析溶质质量增大或溶剂质量减小溶质质量减小或溶剂质量增大溶质质量分数偏大溶质质量分数偏小偏小偏小偏小偏小偏小偏小不变不变不变不变不变不变不变不变偏大偏大偏大偏大偏大偏小不变偏大同比例减小不变不变不变偏小偏大偏小偏大偏大不变偏小不变偏小1. 要配制100g溶质质量分数为10%的氯化钠溶液,下列操作正确的是( )A.将10g氯化钠固体直接放在天平的托盘上称量B.量取90mL水时,俯视读数C.为加快固体溶解,用温度计搅拌溶液D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签D×平视玻璃棒溶质质量分数的综合计算计算 → 称量 → 量取 → 溶解步骤:①写出化学方程式; ②根据化学方程式计算溶质质量; ③计算溶质的质量分数配制一定溶质质量分数的溶液1.小明用石灰石测定某稀盐酸中溶质的质量分数。向盛有100g稀盐酸的烧杯中依次加入石灰石粉末(杂质不参加反应),充分反应后,记录实验数据见下表。请计算:(1)共生成二氧化碳_____g。 (2)所用稀盐酸中溶质的质量分数。8.8解析:根据质量守恒定律,分析题表数据可知,共生成二氧化碳的质量为100g+15g+15g-121.2g=8.8g。(2)解:设100g稀盐酸中溶质的质量为x。答:所用稀盐酸中溶质的质量分数为14.6%。 73 44 x 8.8g所用稀盐酸中溶质的质量分数为2. 实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法正确的是( )A.托盘天平未经调零即用来称取氯化钠固体B.称量时托盘天平指针偏左,移动游码至天平平衡C.量取水时,用规格为50mL的量筒D.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,会使氯化钠溶液的溶质质量分数偏大C解析:托盘天平使用前要先通过调节平衡螺母调节天平平衡;称量时托盘天平指针偏左,应减少左盘中的药品;经计算所需氯化钠固体质量为 50g×15% = 7.5g,所需水的质量为 50g-7.5g = 42.5g,即42.5毫升;把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,会使氯化钠溶液的溶质的质量分数偏小。3. 配制一定溶质质量分数氯化钠溶液的过程如图所示: (1)写出图中标号a仪器的名称:______。 (2)配制50g质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠_____g,水______g。 (3)称量氯化钠时,氯化钠应放在托盘天平的____盘(填“左”或“右”)。量筒7.542.5左(2)氯化钠的质量为50g×15% = 7.5g;水的质量为50g-7.5g=42.5g。(4)把50g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是______g。100解析:(4)把50g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,根据稀释前后溶质质量不变,两溶液的差即为需要水的质量: 。 3. 配制一定溶质质量分数氯化钠溶液的过程如图所示: 在约500 mL的饮料瓶中加入2勺白糖和适量果汁,加入约1.5g 小苏打(碳酸氢钠),注入凉开水,再加入约1.5g 柠檬酸,立即旋紧瓶盖,摇匀,放入冰箱。半小时后,你就可以喝到清凉甘甜的汽水了。(注意:自制汽水时应使用食品级的碳酸氢钠和柠檬酸。)自制汽水对应巩固练习见《基础题与中考新考法》
相关资料
更多









