






初中化学课题3 溶液的浓度评课课件ppt
展开1.稀硫酸中溶质的化学式为_________,100 g溶质质量分数为9.8%的盐酸,溶质的质量为______ g;含19.6 g溶质的该稀硫酸的质量为______ g。2.10 g碳酸钙加到盛100 g稀盐酸的烧杯中,完全溶解后产生4.4 g CO2,烧杯中溶液的质量为_______ g。
知识点1 应用溶质的质量分数于化学方程式的计算
【解】设200 g硫酸溶液中H2SO4的质量为x
答:硫酸溶液的质量分数为24.5%
【例题1】32.5 g锌跟200 g硫酸溶液恰好完全反应。该硫酸溶液中溶质的质量分数是多少?(H—1,O—16,S—32,Zn—65)
Zn + H2SO4 === ZnSO4+H2↑
65 98
32.5 g x
【课堂练习1】3 g纯铝片和40 g一定质量分数的氢氧化钠溶液,充分反应后,铝片有剩余,称得反应后剩余物质的总质量为42.7 g。试计算:(2Al+2NaOH+2H2O == 2NaAlO2+3H2↑,Na—23,Al—27)(1)根据质量守恒定律,生成氢气的质量是_____g。
(2)所用氢氧化钠溶液的溶质质量分数。(写出计算过程)
【解】设:40 g氢氧化钠溶液中NaOH的质量为x
答:氢氧化钠溶液的质量分数为10%
2Al+2NaOH+2H2O == 2NaAlO2+3H2↑
80 6
x 0.3 g
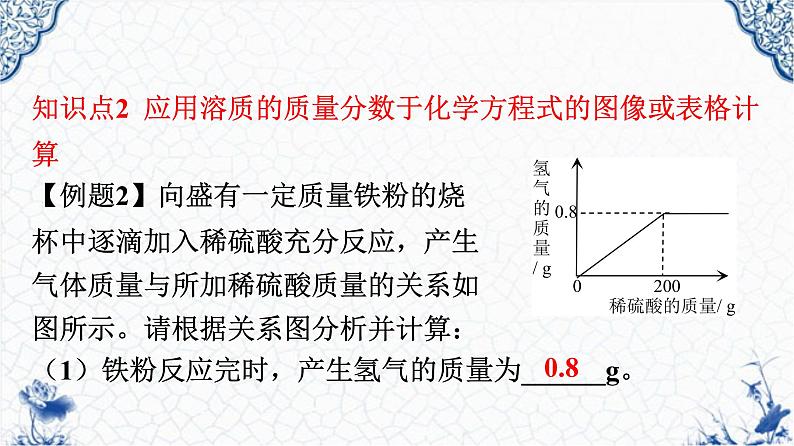
知识点2 应用溶质的质量分数于化学方程式的图像或表格计算【例题2】向盛有一定质量铁粉的烧杯中逐滴加入稀硫酸充分反应,产生气体质量与所加稀硫酸质量的关系如图所示。请根据关系图分析并计算:(1)铁粉反应完时,产生氢气的质量为______g。
(2)稀硫酸中溶质的质量分数是多少?
【解】设:200 g硫酸溶液中H2SO4的质量为x
答:硫酸溶液的质量分数为19.6%
x 0.8 g
98 2
Fe + H2SO4 === FeSO4+H2↑
(3)恰好反应时,所得溶液中(不饱和)的溶质质量分数是多少?(精确到0.1%)
【解】设:恰好反应所得溶液中FeSO4的质量为y
答:所得溶液的溶质质量分数为27.4%
y 0.8 g
152 2
【课堂练习2】为测定某大理石中CaCO3的含量。称取20 g样品于烧杯中,将250 g稀盐酸分成五等份,依次加入,充分反应,数据如右表所示(不计杂质影响)。
(1)m的值应为____;反应中稀盐酸有剩余的是第_______实验。
(2)实验中所用稀盐酸的溶质质量分数是多少?(H—1,C—12,O—16,Cl—35.5,Ca—40)
【解】设:50 g盐酸中HCl的质量为x
答:盐酸溶质的质量分数为7.3%
100 73
5 g x
CaCO3+2HCl === CaCl2+H2O+CO2↑
1.氧化亚铜与稀硫酸反应的化学方程式为:Cu2O+H2SO4 == CuSO4+Cu+H2O。现取一定量的氧化亚铜,加入100 g的稀硫酸,它们恰好完全反应。反应完全后,过滤、洗涤、干燥得红色固体6.4 g。稀硫酸的溶质质量分数是多少?(H—1,O—16,S—32,Cu—64)
【解】设:100 g硫酸溶液中H2SO4的质量为x
答:硫酸溶液溶质的质量分数为9.8%
x 6.4 g
98 64
Cu2O+H2SO4 == CuSO4+Cu+H2O
2.实验室用34 g过氧化氢溶液和1 g二氧化锰制取氧气,实验的相关数据如右图。请回答:(1)反应生成氧气的质量为_____g。
(2)计算过氧化氢溶液中溶质的质量分数。(写出计算过程)
【解】设:34 g过氧化氢溶液中H2O2的质量为x
答:过氧化氢溶液中溶质的质量分数为10%
2H2O2 == 2H2O + O2↑
68 32
x 1.6 g
1.递增式滴加试剂的表格计算:(1)求题干内的物质,一般适宜选择表格内生成物中数据最大的为计算依据。(2)求表格内的物质,宜选择第一组数据,第一组数据所加物质一般都充分反应,没有过量。
2.易错点(1)怎样判断所加试剂有没有反应完全?看比例关系,若不成比例,则反应已经完成,理清每一组数据,是选择计算依据进行化学方程式计算的基础。所计算的物质必须完全反应,没有过量。
初中化学人教版九年级下册课题3 溶液的浓度教学ppt课件: 这是一份初中化学人教版九年级下册课题3 溶液的浓度教学ppt课件,共20页。PPT课件主要包含了硫酸铜溶液,溶液的浓度,一溶质质量分数,合作探究1,合作探究2,谈体会说收获,练一练等内容,欢迎下载使用。
人教版九年级下册课题3 溶液的浓度课文配套课件ppt: 这是一份人教版九年级下册课题3 溶液的浓度课文配套课件ppt,文件包含课题3溶质质量分数第1课时pptx、课题3溶质质量分数第3课时pptx、课题3溶质质量分数第2课时pptx、3份氯化钠加入不同量水中mp4、三种浓度不同的硫酸铜溶液剪后mp4、哪个更甜1勺2勺糖mp4、哪个更甜mp4、溶质质量分数的概念mp4等8份课件配套教学资源,其中PPT共54页, 欢迎下载使用。
初中化学课题3 溶液的浓度优秀课件ppt: 这是一份初中化学课题3 溶液的浓度优秀课件ppt,共60页。PPT课件主要包含了溶液的浓度,溶液的配制,实验步骤,过程方法,实验器材,注意事项,1计算,装瓶贴标签,固体+水,步6器8注意等内容,欢迎下载使用。













