



初中化学课题3 有机合成材料说课ppt课件
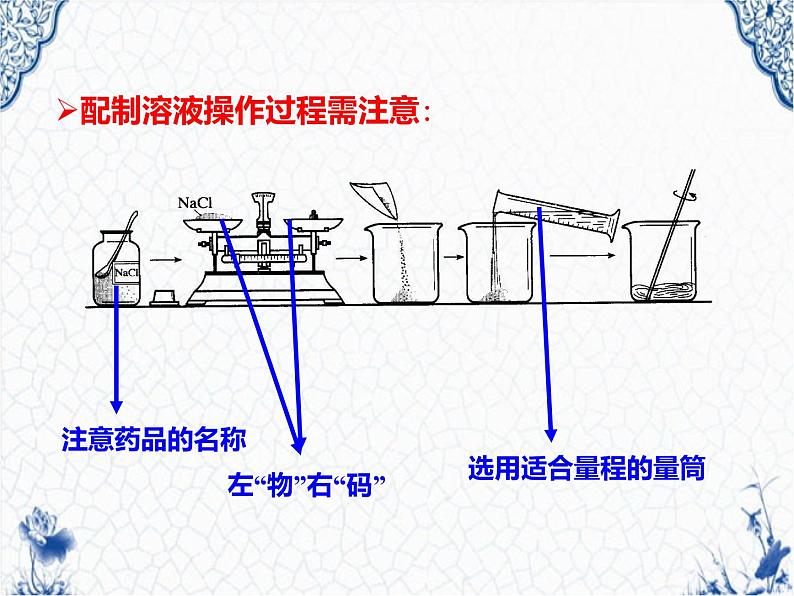
展开配制溶液操作过程需注意:
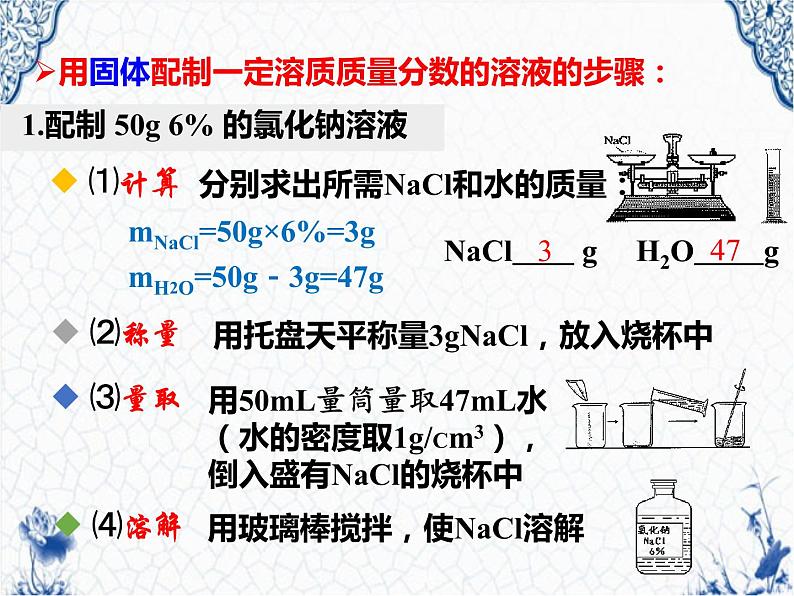
1.配制 50g 6% 的氯化钠溶液
NaCl g H2O g
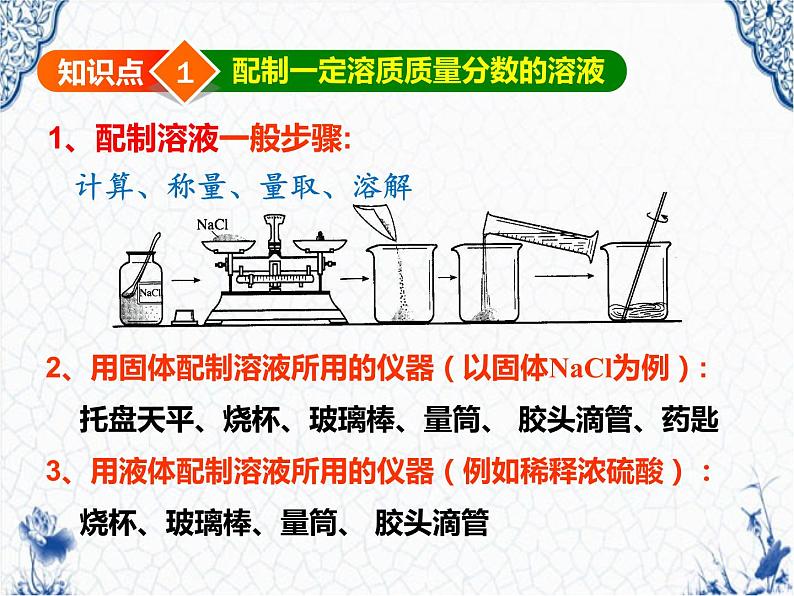
用固体配制一定溶质质量分数的溶液的步骤:
分别求出所需NaCl和水的质量:
mNaCl=50g×6%=3g
mH2O=50g-3g=47g
用托盘天平称量3gNaCl,放入烧杯中
用50mL量筒量取47mL水(水的密度取1g/Cm3),倒入盛有NaCl的烧杯中
用玻璃棒搅拌,使NaCl溶解
用液体溶液配制一定溶质质量分数的溶液的步骤 (溶液的稀释):
分别求出所需6%的NaCl溶液和水的质量,再由质量求出其体积:
50g×3%=mNaCl液×6% mNaCl液=25g
mH2O=50g-25g=25g
用玻璃棒搅拌,使溶液混合均匀。
2.配制质量分数为3% 的氯化钠溶液
用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。
25g÷1.04g/cm3=24mL
6%的氯化钠溶液 g(体积 mL );水 g。
用量筒量取24mL的6%氯化钠溶液和25mL的水,倒入烧杯中。
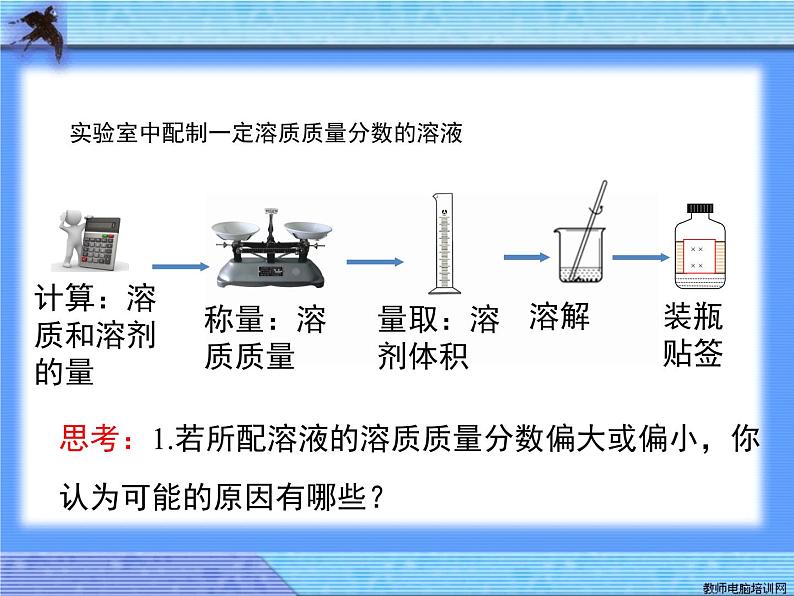
实验室中配制一定溶质质量分数的溶液
思考:1.若所配溶液的溶质质量分数偏大或偏小,你认为可能的原因有哪些?
在配制溶液的过程中,量取水时,如果俯视、仰视刻度线,分别导致的后果是什么?
量取水时,如果俯视刻度线会使取用的水的体积偏少,最终导致所配制溶液的浓度偏大;相反,仰视刻度线会使所配制溶液的浓度偏小。
造成配制溶液浓度偏小的可能原因 ①溶质溶解的量变少:溶质本身不纯;左码右物称量;溶质有撒落;溶质没有完全溶解就装瓶存放 ②溶剂的量增多:仰视量取;烧杯内壁上有水;试剂瓶内壁上有水造成配制溶液浓度偏大的可能原因 ①溶质溶解的量变多:称量时,所用砝码已生锈或沾有油污 ②溶剂的量减少: 俯视量取溶剂;量取的水没有完全转移到烧杯中
【例1】下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。
1、药品选择错误 2、瓶塞没有倒放 3、没有左物右码 4、量筒没有紧挨烧杯壁 5、用温度计搅拌
某工厂化验室配制5000g 20%的盐酸,需38%的盐酸(密度为1.19 g/cm3)多少毫升?
能否用体积直接带入公式进行计算?
溶质质量=溶液体积×溶液密度×溶质的质量分数。
解:设需38%的盐酸的体积为x。5000 g×20%=1.19 g/cm3×x×38%,x≈2211mL。答:需38%的盐酸2211mL。
已知,13g的锌与200g稀硫酸恰好完全反应. 求:⑴生成氢气的质量是多少? ⑵所用稀硫酸的溶质质量分数; ⑶反应后所剩溶液的溶质质量分数。
解: ⑴设生成氢气质量为x。
Zn+H2SO4=ZnSO4+H2↑
213g x
答:生成氢气质量为0.4g
已知,13g的锌与200g稀硫酸恰好完全反应. 求:⑴生成氢气的质量是多少? ⑵所用稀硫酸的溶质质量分数; ⑶反应后所剩溶液的溶质质量分数。
解: ⑵设稀硫酸中含溶质质量为y。
9813g y
稀硫酸的溶质质量分数为:
答:所用浓硫酸的溶质质量分数为9.8%
解:⑶设所剩溶液中含溶质质量为z。
16113g z
方法一:硫酸锌溶液的质量=水的质量+硫酸锌的质量; 硫酸锌的溶质质量分数为:
方法二:根据质量守恒定律锌的质量+稀硫酸的质量=硫酸锌溶液的质量+氢气的质量。硫酸锌溶液的质量=锌的质量+稀硫酸的质量-氢气的质量。硫酸锌的溶质质量分数为:
溶液是混合物,溶液的质量不能直接代入化学方程式中计算,代入的已知量和未知量均为纯量,则溶液中只有溶质参加化学反应。
利用化学方程式进行溶液中溶质质量分数的计算步骤:
选准化学方程式。找出要求哪些量。选准有效的数值代入化学方程式进行计算。
所剩溶液的质量计算方法:溶液组成法 :溶液质量=溶质质量+溶剂质量
质量守恒法利用质量守恒定律:反应前后的物质总质量不变。反应后溶液的质量=反应前各物质的质量总和- 不溶性杂质-生成沉淀的质量-生成气体的质量。
1、(2019平凉)某兴趣小组用氯酸钾与二氧化锰的混合物制取氧气,试管中固体的质量随时间变化的数据见下表。制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液200g。请计算:(1)共制得氧气 g。(2)所得氯化钾溶液中溶质的质量分数。
(2)解:设反应生成氯化钾的质量为x。 2KClO3 = 2KCl+3O2↑ 149 96 x 9.6 g
(1)共制得氧气:26.0g -16.4g = 9.6g
2、向盛有一定质量铁粉的烧杯中逐滴加入稀硫酸充分反应,产生气体质量与所加稀硫酸质量的关系如图所示。请根据关系图分析并计算:(1)铁粉反应完时,产生氢气的质量为______g。
(2)稀硫酸中溶质的质量分数是多少?
【解】设:200 g硫酸溶液中H2SO4的质量为x
答:硫酸溶液的质量分数为19.6%
x 0.8 g
98 2
Fe + H2SO4 === FeSO4+H2↑
(3)恰好反应时,所得溶液中(不饱和)的溶质质量分数是多少?(精确到0.1%)
【解】设:恰好反应所得溶液中FeSO4的质量为y
答:所得溶液的溶质质量分数为27.4%
y 0.8 g
152 2
3、为测定某大理石中CaCO3的含量。称取20 g样品于烧杯中,将250 g稀盐酸分成五等份,依次加入,充分反应,数据如右表所示(不计杂质影响)。
(1)m的值应为____;反应中稀盐酸有剩余的是第_______实验。
(2)实验中所用稀盐酸的溶质质量分数是多少?(H—1,C—12,O—16,Cl—35.5,Ca—40)
【解】设:50 g盐酸中HCl的质量为x
答:盐酸溶质的质量分数为7.3%
100 73
5 g x
CaCO3+2HCl === CaCl2+H2O+CO2↑
初中化学课题3 溶液的浓度评优课课件ppt: 这是一份初中化学课题3 溶液的浓度评优课课件ppt,文件包含第2课时溶质质量分数的综合计算课件pptx、第2课时溶质质量分数的综合计算导学案doc、第2课时溶质质量分数的综合计算教案doc等3份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
人教版九年级下册课题3 溶液的浓度习题课件ppt: 这是一份人教版九年级下册课题3 溶液的浓度习题课件ppt,共22页。PPT课件主要包含了增大反应物的接触面积等内容,欢迎下载使用。
初中化学人教版九年级下册课题3 溶液的浓度一等奖习题ppt课件: 这是一份初中化学人教版九年级下册课题3 溶液的浓度一等奖习题ppt课件,文件包含化学人教版九年级下册第九单元课题3第2课时《溶质质量分数的综合计算》课件pptx、化学人教版九年级下册第九单元课题3第2课时《溶质质量分数的综合计算》同步练习docx、化学人教版九年级下册第九单元课题3第2课时《溶质质量分数的综合计算》教案docx等3份课件配套教学资源,其中PPT共19页, 欢迎下载使用。













