






高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解图片ppt课件
展开
这是一份高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解图片ppt课件,共30页。PPT课件主要包含了影响盐类水解的因素,实验结论,越弱越水解,探究实验,越热越水解,中和反应放热,盐类水解反应吸热,探究活动,论证方法,数据论证等内容,欢迎下载使用。
影响盐类水解的因素有哪些?
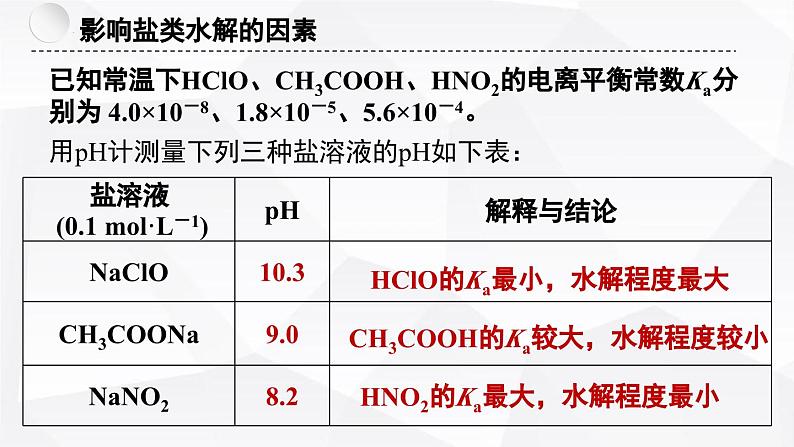
已知常温下HClO、CH3COOH、HNO2的电离平衡常数Ka分别为 4.0×10-8、1.8×10-5、5.6×10-4。
用pH计测量下列三种盐溶液的pH如下表:
HClO的Ka最小,水解程度最大
CH3COOH的Ka较大,水解程度较小
HNO2的Ka最大,水解程度最小
在盐水解过程中,若生成的弱电解质越难电离,则生成弱电解质的倾向越大,盐水解程度就越大,溶液中c(H+)和c(OH-)的差别越大。
盐类水解程度的大小,主要由盐的性质所决定。
正盐离子比其对应酸式盐离子的水解程度大。
盐的离子对应的酸或碱越弱,则水解程度越大,即
如:物质的量浓度相同时,pH: Na2CO3 NaHCO3。
分别对FeCl3溶液冷水浴和热水浴,比较颜色深浅。
已知0.1 ml·L-1 Fe(NO3)3发生水解反应的离子方程式:
【实验验证】温度对FeCl3水解平衡的影响
结论:升温,水解平衡正向移动,盐的水解程度增大。
温度对盐类水解的理论解释
盐类水解是酸碱中和反应的逆反应
验证反应物浓度对水解平衡的影响
比较浓度商与平衡常数的大小关系,进行论证。
在同一温度下: Q = K ,处于化学平衡状态 Q < K ,向正反应方向进行 Q > K ,向逆反应方向进行
【数据论证】用平衡常数分析反应条件的影响
分别对FeCl3溶液加入少量浓酸或浓碱,比较颜色深浅。
验证溶液酸碱性对水解平衡的影响
【实验验证】溶液酸碱性对FeCl3水解平衡的影响
结论:c(H+)增大,水解平衡逆向移动,Fe3+水解程度减小。
【实验验证】生成物浓度对FeCl3水解平衡的影响
结论:c(H+)减小,水解平衡正向移动,Fe3+水解程度增大。
溶液的酸碱性对盐类水解的影响与盐的类型有关
先将氯化铁溶于盐酸,再加水稀释。
向沸水中滴加氯化铁溶液,持续加热保持沸腾以促进铁离子的水解。
分析:增大c(H+),可抑制Fe3+的水解。
分析:加热可使水解平衡右移。
将纯碱溶于热水中清洗油污,通过升高温度促进纯碱水解以增强溶液的碱性,增强去污效果。
分析:去油污的是OH-。Na2CO3水解可以生成OH- ,水解反应是吸热的,升温促进Na2CO3水解,使溶液中的c(OH-)增大,去污效果更好。
盐类的水解反应在生产、生活中应用广泛。
净水剂、泡沫灭火器等的使用都运用了盐类水解的原理。
利用水解的原理,人们生产出泡沫灭火器。泡沫灭火器的结构下图所示,内筒盛有硫酸铝溶液,外筒、内筒之间装有碳酸氢钠溶液,使用时将灭火器倒置,两种溶液立即混合并剧烈反应,产生的大量二氧化碳和氢氧化铝等一起以泡沫的形式喷出,覆盖在可燃物表面,从而达到灭火的效果。
泡沫灭火器的构造和原理示意图
FeCl3可用作净水剂
分析:Fe3+水解生成的Fe(OH)3胶体可以使水中细小的悬浮颗粒聚集成较大的颗粒而沉降,从而除去水中的悬浮物,起到净水的作用。
明矾[KAl(SO4)2·12H2O]作净水剂也是相同原理。
Fe3++3H2O ⇌Fe(OH)3+3H+
+2)H2O===TiO2·xH2O↓+4HCl
(1)盐水解后的酸能否挥发,碱是否为沉淀。盐水解生成难挥发性酸或生成易溶于水的强碱时,蒸干后一般得到该盐,如MgSO4、Al2(SO4)3、Na2CO3等。盐水解生成易挥发性酸,且生成难溶于水的弱碱时,蒸干(或灼烧)得到对应的弱碱沉淀(或氧化物),如AlCl3、FeCl3等。
(2)盐是否分解。如Ca(HCO3)2、NaHCO3、NH4Cl、KMnO4等受热易分解。(3)盐能否发生氧化反应。如Na2SO3易被O2氧化为Na2SO4。
分析蒸干盐溶液所得物质成分
溶液配制制备胶体制备化合物作净水剂……
盐类水解平衡的影响因素和应用
1.向三份0.1 ml·L-1 CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为___________________________________。
相关课件
这是一份人教版 (2019)选择性必修1第三节 盐类的水解课文ppt课件,共25页。PPT课件主要包含了水解平衡常数,温度对水解平衡的影响,浓度对水解平衡的影响,新课引入,水解平衡常数Kh,思考与讨论,归纳小结等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡实验活动3 盐类水解的应用教案配套ppt课件,共28页。PPT课件主要包含了核心素养发展目标,影响盐类水解的因素,内因盐的性质,Kh只与温度有关,KhKaKw,越弱越水解,甲中溶液颜色变深,制备某些胶体,②③④⑤⑥,达标检测等内容,欢迎下载使用。
这是一份苏教版 (2019)第三单元 盐类的水解试讲课ppt课件,共19页。PPT课件主要包含了随堂反馈,①升温,促进水解,②稀释,③加入物质,盐类水解平衡常数,盐类水解的应用,课堂小结等内容,欢迎下载使用。










