




苏教版 (2019)选择性必修1第三单元 盐类的水解完美版课件ppt
展开一般分析方法如下:(1)识图像①观察纵、横坐标表示何种变量,是pH、浓度还是含量。②观察图像,分析曲线(点、线段)的变化规律。(2)想原理涉及电解质的强弱,影响弱电解质电离平衡的因素,盐类水解的影响因素及溶液中存在的“三大守恒”。(3)找联系将图像与弱电解质的电离及盐类水解相关知识联系起来,分析题目中涉及的问题,利用平衡移动原理分析。
1.pH—酸(或碱)的量变化曲线解决酸碱中和滴定曲线类问题的关键是巧抓“5点”,即曲线的起点、反应一半点、中性点、恰好反应点和过量点,先判断出各点的溶质及溶液的酸碱性。以室温时用0.1 ml·L-1 NaOH溶液滴定20 mL 0.1 ml·L-1 HA溶液为例(如图),总结如何抓住滴定曲线的5个关键点。
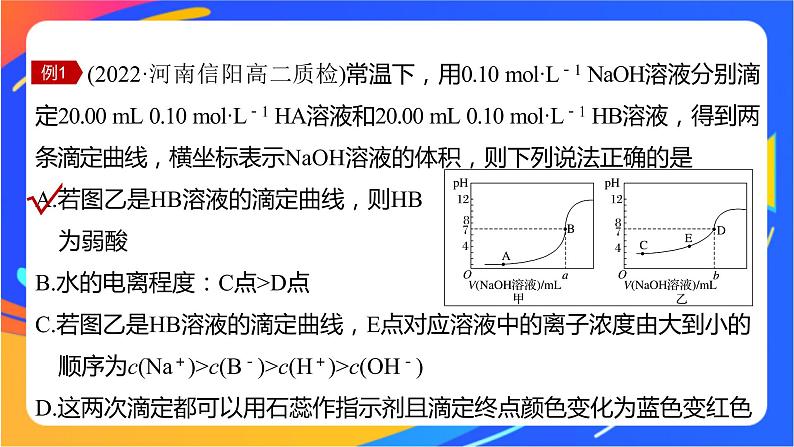
(2022·河南信阳高二质检)常温下,用0.10 ml·L-1 NaOH溶液分别滴定20.00 mL 0.10 ml·L-1 HA溶液和20.00 mL 0.10 ml·L-1 HB溶液,得到两条滴定曲线,横坐标表示NaOH溶液的体积,则下列说法正确的是A.若图乙是HB溶液的滴定曲线,则HB 为弱酸B.水的电离程度:C点>D点C.若图乙是HB溶液的滴定曲线,E点对应溶液中的离子浓度由大到小的 顺序为c(Na+)>c(B-)>c(H+)>c(OH-)D.这两次滴定都可以用石蕊作指示剂且滴定终点颜色变化为蓝色变红色
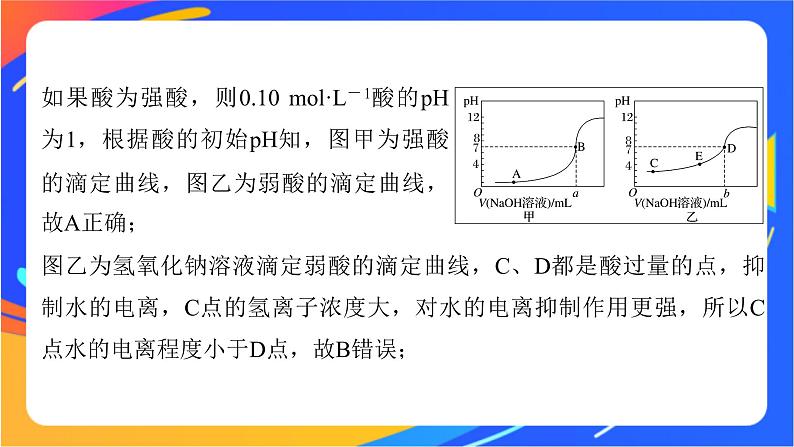
如果酸为强酸,则0.10 ml·L-1酸的pH为1,根据酸的初始pH知,图甲为强酸的滴定曲线,图乙为弱酸的滴定曲线,故A正确;
图乙为氢氧化钠溶液滴定弱酸的滴定曲线,C、D都是酸过量的点,抑制水的电离,C点的氢离子浓度大,对水的电离抑制作用更强,所以C点水的电离程度小于D点,故B错误;
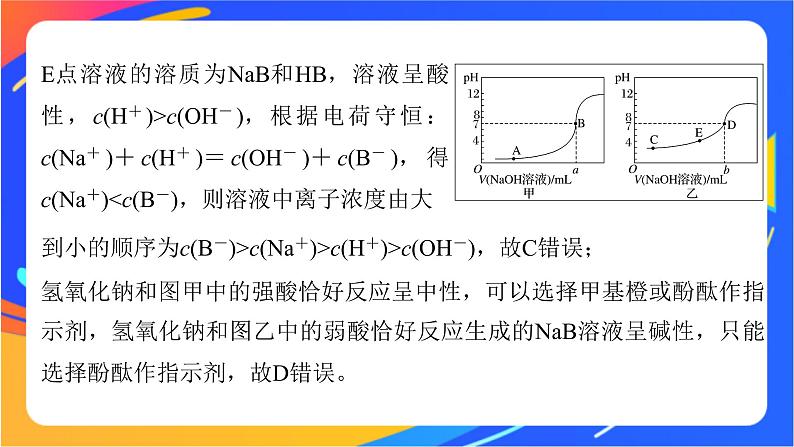
E点溶液的溶质为NaB和HB,溶液呈酸性,c(H+)>c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(B-),得c(Na+)
2.纵、横坐标均为对数的图像(1)pOH—pH曲线pOH=-lg c(OH-)
①表示一元酸与一元碱中和过程中H+与OH-浓度的关系。②Q点代表溶液显中性。③M点溶液显酸性,N点溶液显碱性,两点水的电离程度相同。(2)对数图
(2017·全国卷Ⅰ,13)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是A.Ka2(H2X)的数量级为10-6B.曲线N表示pH与 的变化关系C.NaHX溶液中c(H+)>c(OH-)D.当混合溶液呈中性时:c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
3.分布系数—pH图像分布系数:组分的平衡浓度占总浓度的分数
(2017·全国卷Ⅱ,12)改变0.1 ml·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示
下列叙述错误的是A.pH=1.2时,c(H2A)=c(HA-)B.lg[K2(H2A)]=-=2.7时,c(HA-)>c(H2A)=c(A2-)D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
A项,根据图像,pH=1.2时,H2A和HA-相交,则有c(H2A)=c(HA-),正确;
C项,根据图像,pH=2.7时,H2A和A2-相交,则有c(H2A)=c(A2-),正确;D项,根据pH=4.2时,c(HA-)=c(A2-),由电荷守恒:c(H+)=c(OH-)+c(HA-)+2c(A2-),故c(H+)>c(HA-)=c(A2-),错误。
1.连二次硝酸(H2N2O2)是一种二元酸,常温下,用0.01 ml·L-1的NaOH溶液滴定10 mL 0.01 ml·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图。常温下,下列各点所对应溶液中微粒物质的量浓度关系正确的是
c点:10 mL 0.01 ml·L-1的H2N2O2溶液滴加10 mL 0.01 ml·L-1的NaOH溶液,二者发生反应生成NaHN2O2溶液,此时pH大于7,则 的水解程度大于其电离程度,离子浓度大小比较:c(Na+)>c( )>c(H2N2O2) >c( ),C项错误;
a和b点的溶质都含有NaHN2O2和H2N2O2,但是比例不同,在没有明确的量比关系时,只能书写电荷守恒:2c( )+c( )+c(OH-)=c(Na+)+c(H+),a点pH=6,故2c( )+c( )-c(Na+)=9.9×10-7ml·L-1,A项错误;
2.某温度下,向一定体积0.1 ml·L-1的氨水中逐滴加入等浓度的盐酸,溶液中pOH[pOH=-lg c(OH-)]与pH的变化关系如图所示。下列说法不正确的是A.M点和N点溶液中H2O的电离程度相同B.Q点溶液中,c( )+c(NH3·H2O)=c(Cl-)C.M点溶液的导电能力小于Q点溶液的导电能力D.N点溶液加水稀释,
由于M点溶液呈碱性,N点溶呈酸性,M点溶液中氢氧根离子浓度与N点溶液中氢离子浓度相同,对水的电离抑制能力相同,故两点水的电离程度相同,A正确;
M点溶液中主要溶质为一水合氨,为弱电解质,在溶液中部分电离,溶液中离子浓度较小,Q点溶液中溶质主要为氯化铵,为强电解质,溶液中离子浓度较大,故M点溶液的导电能力小于Q点,C正确;
3.(2022·安徽太和一中高二月考)H2CO3和H2C2O4都是二元弱酸,常温下,不同pH环境中它们不同形态的粒子的分布系数如图所示。下列说法正确的是
A.溶液中水的电离程度:a>b>cB.c点溶液中:c(Na+)=10c(HX)C.室温下NaX的水解平衡常数为10-4.75D.图中b点坐标为(0,4.75)
A项,a、b、c三点处溶液中的溶质均为HX、NaX,三点对应的溶液均为酸性溶液,溶液的pH<7,可知溶液中HX的电离程度大于X-的水解程度,HX的电离会
抑制水的电离,pH越小,HX的电离程度越大,对水的电离的抑制作用就越强,因此溶液中水的电离程度:a<b<c,错误;
D项,a、b、c三点在同一直线上,由a、c两点的坐标可知,该直线的方程为y=x+4.75,当x=0时,y=4.75,因此图中b点的坐标为(0,4.75),正确;
5.常温条件下,向20 mL 0.01 ml·L-1 CH3COOH溶液中逐滴加入0.01 ml·L-1的NaOH溶液,溶液中水电离的c(H+)随加入NaOH溶液的体积变化如图所示,下列说法正确的是A.b、d两点溶液的pH相同B.从a到c,对醋酸的电离既有促 进作用也有抑制作用C.e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH)=0.01 ml·L-1D.从a→c的过程中,存在pH=7的点
b点醋酸过量,其电离使溶液显酸性,pH<7,d点NaOH过量,pH>7,故A错误;醋酸溶液中存在CH3COOH CH3COO-+H+,加NaOH溶液消耗氢离子,醋酸的电离平衡正
向移动,所以从a到c,醋酸的电离始终受到促进,故B错误;e点所示溶液中,加入的NaOH的物质的量是醋酸的物质的量的2倍,反应后溶液中醋酸钠和NaOH物质的量相等,根据物料守恒得c(Na+)=2c(CH3COO-)+2c(CH3COOH)=0.01 ml·L-1× ,故C错误;
c点,醋酸与氢氧化钠恰好完全反应生成醋酸钠,溶液显碱性,氢氧化钠溶液体积小于20 mL时的某一个值恰好使溶液显中性,所以从a→c的过程中,存在着pH=7的点,故D正确。
6.298 K时,某种甲酸(HCOOH)和甲酸钠的混合溶液中HCOOH、HCOO-的浓度存在关系式:c(HCOO-)+c(HCOOH)=0.100 ml·L-1,含碳元素的粒子的浓度与pH的关系如图所示。下列说法正确的是A.298 K时,HCOOH的电离常数Ka=1.0×10- ml·L-1 HCOONa溶液中有c(HCOO-)+ c(HCOOH)+c(OH-)
0.100 ml·L-1 HCOONa溶液和0.100 ml·L-1 HCOOH溶液等体积混合后,虽然混合溶液中c(HCOO-)+c(HCOOH)=0.100 ml·L-1,但由于HCOOH的电离程度大于HCOO-的水解程度,混合溶液中c(HCOO-)>c(HCOOH),故溶液的pH>3.75,D错误。
B.Ka2(H2CrO4)的数量级为10-6
平衡常数K只与温度有关,温度不变,则K不变,D项错误。
高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解图文ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解图文ppt课件,共13页。
高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解作业课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解作业课件ppt,共24页。
苏教版 (2019)选择性必修1第三单元 盐类的水解试讲课ppt课件: 这是一份苏教版 (2019)选择性必修1第三单元 盐类的水解试讲课ppt课件,共22页。PPT课件主要包含了Kh·Ka,深度思考,随着中和,②>①>④>③,5×10-8,③<②<①等内容,欢迎下载使用。













