






还剩20页未读,
继续阅读
所属成套资源:人教版化学九年级下册教学课件
成套系列资料,整套一键下载
人教版化学九年级下册 综合复习与测试第九单元课件
展开
这是一份人教版化学九年级下册 综合复习与测试第九单元课件,共28页。
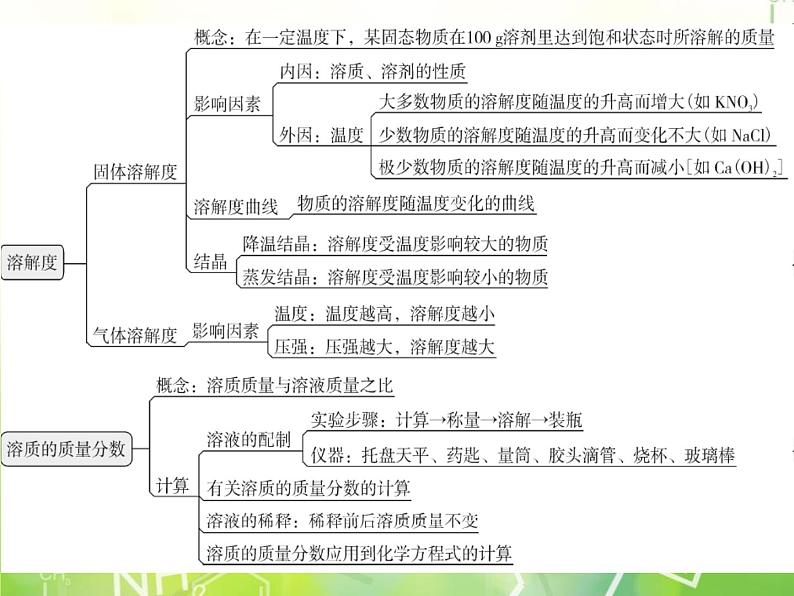
下册第九单元 溶液期末复习精练思维导图考纲要求1. 溶解现象 (认识);2. 溶液是由溶质和溶剂组成的 (知道);3. 水是重要的溶剂,酒精、汽油也是常见的溶剂 (知道);4. 饱和溶液和溶解度的含义 (认识);5. 溶质质量分数的简单计算(理解);6. 配制一定溶质质量分数的溶液 (独立操作);7. 结晶现象 (知道);8. 一些常见的乳化现象 (知道);9. 溶液在生产、生活中的重要意义 (认识)。易错点透析易错点1 对溶液的特征认识不清楚溶液是指一种或几种物质分散到另一种物质里,形成的均一的、稳定的混合物。溶液由溶质和溶剂组成。特征:均一性、稳定性。【例1】溶液与我们的日常生活密切相关,下列关于溶液的说法正确的是( )A. 溶液一定是无色透明的B. 稀溶液也可能是饱和溶液C. 面粉与水混合可形成溶液D. 溶液的上层浓度小,下层浓度大易错提醒:溶液是均一、稳定的混合物,对颜色无要求,可能是无色的,如NaCl溶液,也可能是有色的,如CuSO4溶液。正解:A. 溶液不一定是无色,例如硫酸铜溶液是蓝色,错误;B. 溶液是否饱和与浓稀无关,正确;C. 面粉与水混合形成的是悬浊液不属于溶液,错误;D. 溶液是均一的,溶液的上层浓度和下层浓度相同,错误。答案:B【学以致用】1. 溶液在生产生活中应用广泛。下列有关溶液的说法正确的是( )A. 均一、稳定的液体都是溶液B. 溶液中不能同时存在两种溶质C. 溶液都是无色透明的D. 外界条件不改变,溶质溶剂不会分离D易错点2 对溶质的质量分数理解不透彻溶质的质量分数是溶质质量与溶液质量的比值,在计算溶质质量与溶液质量时要具体情况具体分析,如有时加入的溶质不一定能全部溶解;温度变化,有晶体析出时,此时溶质与溶液质量都有变化。【例2】下列有关溶液的说法正确的是( )A. 溶液中加入溶剂,溶液质量一定增大B. 溶液中恒温加入溶质,溶质质量分数一定增大C. 溶液升温,溶质的质量分数一定增大D. 溶液恒温蒸发溶剂,溶质的质量分数一定减小易错提醒:题目中的溶液既没有指明是哪种溶液,也没有指明溶液饱不饱和,所以向其中加入溶质或升温或恒温蒸发溶剂,都要分情况分析。正解:A. 溶液中加入溶剂,溶液质量一定增大,正确;B. 若是饱和溶液时,向该饱和溶液中恒温加入溶质,溶质不会再溶解,所以溶质的质量分数不变,错误;C. 对于溶解度随温度的升高而减小的固体物质来说,溶液升温时,溶质质量分数减小,错误;D. 恒温蒸发溶剂,若是饱和溶液,析出部分晶体后,溶液仍为饱和溶液,相同温度下的同种物质的饱和溶液溶质质量分数因溶解度相等而相等,错误。答案:A【学以致用】2. 已知浓硫酸的密度比稀硫酸大。溶质质量分数为90%和10%的两硫酸溶液等体积混合,所得溶液的溶质质量分数( )A. 小于50% B. 等于50% C. 大于50% D. 无法确定C易错点3 未能正确认识和使用溶解度曲线溶解度曲线表示的是溶解度随温度变化的曲线,线上的点和线上面区域的点表示的是该温度下的饱和溶液,而线下面的区域对应的是该温度下的不饱和溶液。【例3】根据如图Z9-1所示的溶解度曲线,下列叙述正确的是( )A. 硝酸钾的溶解度比氯化钠大B. t1 ℃时,氯化钠和硝酸钾的溶解度相等C. t2 ℃时,80 g硝酸钾溶于100 g水中得到的溶液为饱和溶液D. 将t1 ℃硝酸钾的饱和溶液温度升高到t2 ℃,溶液质量分数增大易错提醒:对溶解度曲线描述,一定要指明温度。正解:A. 不知温度,无法比较二者溶解度大小,错误;B. 由图可知,t1 ℃时,氯化钠和硝酸钾的溶解度相等,正确;C. t2 ℃时硝酸钾的溶解度是85 g,所以80 g硝酸钾溶于100 g水中得到的溶液为不饱和溶液,错误;D. 硝酸钾的溶解度随温度的升高而增大,所以,将t1 ℃硝酸钾的饱和溶液温度升高到t2 ℃时,溶液为不饱和溶液,溶质的质量分数不变,错误。答案:B【学以致用】3. 如图Z9-2是甲、乙两种物质的溶解度曲线,请回答下列问题:(1)当温度大于_____℃时,甲的溶解度大于乙的溶解度。(2)甲、乙两种物质的溶解度受温度影响较大的是_____物质。(3)采用______________________________的方法可以将乙的不饱和溶液变成饱和溶液。(4)60 ℃时,在100 g水中加入100 g甲,充分溶解后溶液质量为______g。20甲增加乙溶质(或升高温度或蒸发溶剂)160考点突破考点1 溶液的形成考点分析:本考点掌握溶液的概念和特征(均一性、稳定性、混合物)。注意溶液不一定是无色的,溶质可以是固体、液体或气体。熟记常见物质溶于水的热效应,如NaOH溶于水放热,NH4NO3溶于水吸热,NaCl溶于水变化不大。1. (2018临沂)下列液体不属于溶液的是( )A. 冰水 B. 碘酒 C. 食盐水 D. 浓盐酸2. (2018绵阳)现有一杯蔗糖溶液,实验测得其上部的密度为a g/cm3,中部的密度为b g/cm3,下部的密度为c g/cm3,则正确的判断是( )A. ab>c C. c>b=a D. a=b=cAD3. (2017怀化)下列有关溶液的说法正确的是( )A. 溶液都是均一、稳定的混合物B. 形成溶液的溶质都是固体C. 所有饱和溶液都比不饱和溶液要浓 D. 溶液的体积等于溶质的体积与溶剂的体积之和考点2 饱和溶液与不饱和溶液考点分析:本考点要掌握判断溶液是否饱和的方法(单一溶质):①有固体剩余的一定是饱和溶液;②条件不变时,向溶液中加入少量同种溶质,不能继续溶解的一定是饱和溶液;③有晶体析出的溶液一定是饱和溶液。A4. (2008广东)20 ℃时,NaCl溶解于水的实验数据如下表。则下列叙述正确的是( )A. ②中所得溶液是饱和溶液 B. 20 ℃时10 g水最多能溶解4 g NaClC. ③④溶液的溶质质量分数相等 D. ①所得溶液的溶质质量分数为20%C5. (2018哈尔滨)某次蔗糖溶解实验过程如图Z9-3所示,不考虑水分蒸发,下列判断错误的是( )A. ②中溶液是饱和溶液B. ③中溶液的溶质质量大于②中溶液的溶质质量C. ②③中溶液的溶质质量分数不相同D. ③中溶液一定是不饱和溶液D6. (2018咸宁) 在t1 ℃时,将等质量的硝酸钾和氯化钾分别加入各盛有100 g水的两个烧杯中,充分搅拌后现象如图Z9-4甲所示,硝酸钾和氯化钾的溶解度曲线如图Z9-4乙所示。下列说法错误的是( )A. 烧杯②中的上层溶液是饱和溶液B. 烧杯①中溶液的溶质是硝酸钾C. 烧杯①中溶液质量比烧杯②中溶液质量大D. 将温度升高到t2 ℃,烧杯②中的固体全部溶解B考点3 溶解度与溶解度曲线考点分析:本考点主要考查溶解度四要素:一定温度、100 g溶剂、达到饱和状态、溶质的质量,掌握溶解度曲线图或溶解度表格的每个部分的含义。7. (2014广东)KCl与KNO3在不同温度的溶解度数据如下表,则下列说法正确的是( )A. KNO3比KCl的溶解度大B. 两物质的溶解度相等的温度在20~30 ℃C. 在20 ℃时,10 g水中加入5 g KCl可得到33.3% 的KCl溶液D. 在50 ℃时,两物质各5 g分别加入10 g水中, 充分溶解,均有固体剩余B8. (2016广东)图Z9-5为三种物质的溶解度曲线。下列说法错误的是( )A. 约在64℃时KCl和Na2SO4的溶解度相等B. 在室温至100℃区间,随温度升高,Na2SO4的溶解度先增大后减小,醋酸钙则相反C. 分离含少量KCl的Na2SO4溶液,采用先蒸发浓缩,再降温结晶的方法D. 在40℃时,40g KCl固体溶于60g水得到40%的KCl溶液D9. (2017广东)如图Z9-6为四种物质的溶解度曲线,则下列说法错误的是( )A. 当温度为10 ℃时,物质溶解度关系为①>③>②>④B. 若NH4H2PO4中混有少量NaCl杂质,可在较高温度配成饱和溶液,再降温结晶C. 在10 ℃时把NH4H2PO4和Ce2(SO4)3的饱和溶液升温到30 ℃,有晶体析出的是Ce2(SO4)3D. 22 ℃时(NH4)2HPO4饱和溶液的质量分数约为70%D10. (2013广东)图Z9-7是A、B两种物质的溶解度曲线,根据图示回答下列问题:(1)t1 ℃时,A、B两种物质的溶解度是A_____(填“>”“<”或“=”,下同)B。(2)将t3 ℃的A、B两种物质的饱和溶液各200 g,降温至t1 ℃,析出晶体的质量关系是A______B。(3)t2 ℃时,100 g水中溶解50 g A刚好饱和,那么50 g水中溶解____g B也刚好达饱和,此时溶液的质量分数是______(精确到0.1%)。<>2533.3%11. (2014广东)溶液M中的溶质是Na2SO4和杂质NaCl,观察图Z9-8所示的溶解度曲线,则操作b是:先将溶液M蒸发浓缩,再降温结晶、过滤。降温结晶的最佳温度范是_____℃以下,因为Na2SO4的溶解度_______________________。30在30 ℃以下比氯化钠小12. (2018广东)图Z9-9为两物质的溶解度曲线。请回答:(1)50 ℃时,Na2Cr2O7的溶解度为_____g;60 ℃时溶解度: Na2Cr2O7______(填“>”“<”或“=”)Na2SO4。(2)在50 ℃时,把210 g Na2Cr2O7饱和溶液降温到10 ℃时,析出Na2Cr2O7______g(假设不含结晶水)。110>50考点4 溶质的质量分数考点分析:有关配制一定溶质质量分数的溶液的题目,关键是记住所用的仪器及操作步骤,以及各步骤的注意事项。熟悉常用的计算公式是解决有关溶液相关计算题目的关键。13. (2018扬州)将100 g 98%的浓硫酸注入900 g水中,所得稀硫酸中溶质的质量分数为( )A. 9.8% B. 10.9% C. 10.0% D. 11.1%14. (2018内江)实验室用氯化钠固体配制质量分数为6%的氯化钠溶液,不需要用到的仪器是( )A. 烧杯 B. 集气瓶 C. 量筒 D. 托盘天平AB15. (2017广东)如图Z9-10是实验室配制一定溶质质量分数的NaCl溶液的流程图。(1)应称量______g NaCl,需加水______mL。(2)若称量NaCl固体时指针向右偏转,则应________________________________________直到天平平衡。(3)取上述溶液10 g加水稀释到______g,可得到5%的NaCl溶液。7.542.5继续向左盘添加NaCl3016. (2018雅安)味精是常用的调味品,它的鲜味来自其中的主要成分谷氨酸钠(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl,其他成分不考虑。请回答下列问题:(1)味精中至少含有______种元素。(2)称取5.0 g味精配制成50 g溶液,量取蒸馏水的量筒规格是______(填字母)。A. 5 mL B. 10 mL C. 50 mL D. 100 mL6C(3)图Z9-11是配制过程,正确的操作顺序为_____(填字母) 。A. ①②③④ B.②①④③ C.②④①③(4)在其他操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制溶液中,谷氨酸钠的质量分数______(填“偏大”“偏小”或“无影响”)。B偏小
下册第九单元 溶液期末复习精练思维导图考纲要求1. 溶解现象 (认识);2. 溶液是由溶质和溶剂组成的 (知道);3. 水是重要的溶剂,酒精、汽油也是常见的溶剂 (知道);4. 饱和溶液和溶解度的含义 (认识);5. 溶质质量分数的简单计算(理解);6. 配制一定溶质质量分数的溶液 (独立操作);7. 结晶现象 (知道);8. 一些常见的乳化现象 (知道);9. 溶液在生产、生活中的重要意义 (认识)。易错点透析易错点1 对溶液的特征认识不清楚溶液是指一种或几种物质分散到另一种物质里,形成的均一的、稳定的混合物。溶液由溶质和溶剂组成。特征:均一性、稳定性。【例1】溶液与我们的日常生活密切相关,下列关于溶液的说法正确的是( )A. 溶液一定是无色透明的B. 稀溶液也可能是饱和溶液C. 面粉与水混合可形成溶液D. 溶液的上层浓度小,下层浓度大易错提醒:溶液是均一、稳定的混合物,对颜色无要求,可能是无色的,如NaCl溶液,也可能是有色的,如CuSO4溶液。正解:A. 溶液不一定是无色,例如硫酸铜溶液是蓝色,错误;B. 溶液是否饱和与浓稀无关,正确;C. 面粉与水混合形成的是悬浊液不属于溶液,错误;D. 溶液是均一的,溶液的上层浓度和下层浓度相同,错误。答案:B【学以致用】1. 溶液在生产生活中应用广泛。下列有关溶液的说法正确的是( )A. 均一、稳定的液体都是溶液B. 溶液中不能同时存在两种溶质C. 溶液都是无色透明的D. 外界条件不改变,溶质溶剂不会分离D易错点2 对溶质的质量分数理解不透彻溶质的质量分数是溶质质量与溶液质量的比值,在计算溶质质量与溶液质量时要具体情况具体分析,如有时加入的溶质不一定能全部溶解;温度变化,有晶体析出时,此时溶质与溶液质量都有变化。【例2】下列有关溶液的说法正确的是( )A. 溶液中加入溶剂,溶液质量一定增大B. 溶液中恒温加入溶质,溶质质量分数一定增大C. 溶液升温,溶质的质量分数一定增大D. 溶液恒温蒸发溶剂,溶质的质量分数一定减小易错提醒:题目中的溶液既没有指明是哪种溶液,也没有指明溶液饱不饱和,所以向其中加入溶质或升温或恒温蒸发溶剂,都要分情况分析。正解:A. 溶液中加入溶剂,溶液质量一定增大,正确;B. 若是饱和溶液时,向该饱和溶液中恒温加入溶质,溶质不会再溶解,所以溶质的质量分数不变,错误;C. 对于溶解度随温度的升高而减小的固体物质来说,溶液升温时,溶质质量分数减小,错误;D. 恒温蒸发溶剂,若是饱和溶液,析出部分晶体后,溶液仍为饱和溶液,相同温度下的同种物质的饱和溶液溶质质量分数因溶解度相等而相等,错误。答案:A【学以致用】2. 已知浓硫酸的密度比稀硫酸大。溶质质量分数为90%和10%的两硫酸溶液等体积混合,所得溶液的溶质质量分数( )A. 小于50% B. 等于50% C. 大于50% D. 无法确定C易错点3 未能正确认识和使用溶解度曲线溶解度曲线表示的是溶解度随温度变化的曲线,线上的点和线上面区域的点表示的是该温度下的饱和溶液,而线下面的区域对应的是该温度下的不饱和溶液。【例3】根据如图Z9-1所示的溶解度曲线,下列叙述正确的是( )A. 硝酸钾的溶解度比氯化钠大B. t1 ℃时,氯化钠和硝酸钾的溶解度相等C. t2 ℃时,80 g硝酸钾溶于100 g水中得到的溶液为饱和溶液D. 将t1 ℃硝酸钾的饱和溶液温度升高到t2 ℃,溶液质量分数增大易错提醒:对溶解度曲线描述,一定要指明温度。正解:A. 不知温度,无法比较二者溶解度大小,错误;B. 由图可知,t1 ℃时,氯化钠和硝酸钾的溶解度相等,正确;C. t2 ℃时硝酸钾的溶解度是85 g,所以80 g硝酸钾溶于100 g水中得到的溶液为不饱和溶液,错误;D. 硝酸钾的溶解度随温度的升高而增大,所以,将t1 ℃硝酸钾的饱和溶液温度升高到t2 ℃时,溶液为不饱和溶液,溶质的质量分数不变,错误。答案:B【学以致用】3. 如图Z9-2是甲、乙两种物质的溶解度曲线,请回答下列问题:(1)当温度大于_____℃时,甲的溶解度大于乙的溶解度。(2)甲、乙两种物质的溶解度受温度影响较大的是_____物质。(3)采用______________________________的方法可以将乙的不饱和溶液变成饱和溶液。(4)60 ℃时,在100 g水中加入100 g甲,充分溶解后溶液质量为______g。20甲增加乙溶质(或升高温度或蒸发溶剂)160考点突破考点1 溶液的形成考点分析:本考点掌握溶液的概念和特征(均一性、稳定性、混合物)。注意溶液不一定是无色的,溶质可以是固体、液体或气体。熟记常见物质溶于水的热效应,如NaOH溶于水放热,NH4NO3溶于水吸热,NaCl溶于水变化不大。1. (2018临沂)下列液体不属于溶液的是( )A. 冰水 B. 碘酒 C. 食盐水 D. 浓盐酸2. (2018绵阳)现有一杯蔗糖溶液,实验测得其上部的密度为a g/cm3,中部的密度为b g/cm3,下部的密度为c g/cm3,则正确的判断是( )A. a
相关资料
更多









