






化学人教版课题 2 金属的化学性质授课ppt课件
展开南宋时期的“南海一号”黄金手镯仍然金光闪闪;打捞出水的一万多枚铜钱保存较好,可记载古船沉没时间;古船携带的铁锅却锈蚀严重,变成了铁疙瘩。
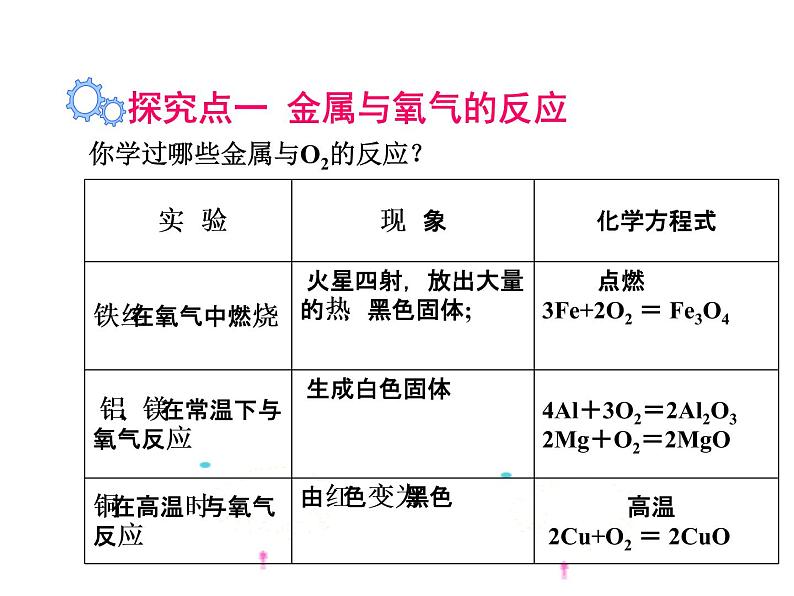
你学过哪些金属与O2的反应?
探究点一 金属与氧气的反应
1.为什么铝具有优良的抗腐蚀性能?
2.分析“真金不怕火炼”蕴含的化学原理。
4Al+3O2=2Al2O3 生成致密的氧化铝薄膜,起保护作用
我们从上述实验事实可以发现:(1)镁、铝比较活泼;(2)铁、铜次之;(3)金最不活泼(“真金不怕火炼”)。
1.判断金属活动性的方法一: 可根据金属与氧气反应的难易程度或者相同条件下反应现象的剧烈程度进行判断
2.大多数金属都能与氧气发生反应
实验室制取氢气的药品:
实验室常用锌和稀硫酸反应来制取氢气 Zn + H2SO4 = ZnSO4 + H2↑
探究点二 金属与盐酸、稀硫酸的反应
讨论:观察这幅卡通图,你有何感想?
反应速度较快,产生气泡
反应速度较慢,产生气泡,溶液由无色变为浅绿色
反应速度很快,产生大量气泡
为什么镁、锌、铁、铜在相同的条件下与相同浓度的盐酸、稀硫酸反应的现象会不一样呢?
金属活动性(金属的活泼程度)不一样
Mg > Zn > Fe > (H)> Cu
1.大多数金属能与盐酸或稀硫酸发生置换反应。 2.判断金属活动性的方法二: 可根据金属是否与盐酸或稀硫酸反应,或反应的剧烈程度判断金属的活动性强弱。
我来试试写出这些化学方程式
Mg + H2SO4 == MgSO4 + H2↑ Fe + H2SO4 == FeSO4 + H2↑ Zn + H2SO4 == ZnSO4 + H2↑ 2Al + 3H2SO4 == Al2(SO4)3 + 3H2↑
置换反应:一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。
化合反应由两种或两种以上物质生成另一种物质的反应分解反应由一种反应物生成两种或以上其他物质的反应
CaO+H2O==Ca(OH)2
A==B+C (+D)
思考:这个反应是置换反应吗?
CaCO3+2HCl==CaCl2+H2CO3
置换反应用字母怎么表示呢?
必须是一种单质置换出另一种单质
学过的反应中有置换反应吗?
H2 + CuO == Cu + H2OC + CuO == Cu + CO2CO + CuO == Cu + CO2
◆ 金属的化学性质: 1.与氧气反应 2.与稀盐酸(稀硫酸)反应 (金属越活泼,反应越容易,越剧烈) ◆ 置换反应 A+BC==B+AC ◆ 金属活动性 Mg > Zn > Fe > (H)> Cu
课题2 金属的化学性质
第八单元 金属和金属材料
第2课时 金属活动性顺序
将铁钉投入到硫酸铜溶液中有何现象?
该反应的化学方程式:
Fe + CuSO4==== Cu + FeSO4
活动性强的金属可以把活动性弱的金属从它的化合物溶液中置换出来。
设计实验判断Al和Cu的活动性强弱
实验药品: 铝片、铜丝、硫酸铝溶液、硫酸铜溶液
( Al 、 Cu 、 Al2(SO4)3 、 CuSO4 )
探究点三 金属活动性顺序
浸入溶液中的铝片表面覆盖一层紫红色物质,溶液由蓝色逐渐变为无色。
2Al + 3CuSO4= Al2(SO4)3 + 3Cu
结论:活动性强弱 Al > Cu
设计实验判断Cu、Ag的活动性强弱
提供的实验药品: 铜丝(Cu)、硝酸银溶液 (AgNO3)
浸入溶液中的铜丝表面覆盖一层银白色物质析出,溶液由无色逐渐变为蓝色。
结论:活动性强弱 Cu > Ag
Cu +2AgNO3 =Cu(NO3)2 + 2Ag
k Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。2.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。3.在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
有X、 Y 、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y的表面有银析出,而Z无变化.根据以上事实,判断X Y Z的金属活动顺序。
答案: 金属活动性顺序 X>Y>Z
2.判断金属活动性的方法
(2)金属能否与其它金属化合物的溶液反应
(1)金属与酸反应的剧烈程度
人教版九年级下册课题 2 金属的化学性质公开课课件ppt: 这是一份人教版九年级下册课题 2 金属的化学性质公开课课件ppt,共24页。PPT课件主要包含了金属与氧气反应,镁与氧气反应,铁与氧气反应,铜与氧气反应,铝与氧气反应,不能真金不怕火炼,金属活动性,金属与酸反应,实验现象,①镁与盐酸反应等内容,欢迎下载使用。
初中化学课题 2 金属的化学性质图片课件ppt: 这是一份初中化学课题 2 金属的化学性质图片课件ppt,共40页。PPT课件主要包含了A+BAB,实验探究等内容,欢迎下载使用。
化学九年级下册第八单元 金属和金属材料课题 2 金属的化学性质授课课件ppt: 这是一份化学九年级下册第八单元 金属和金属材料课题 2 金属的化学性质授课课件ppt,共26页。PPT课件主要包含了学习目标,活动与探究一,金属与氧气的反应,金属与酸的反应,谈谈我们这节课的收获,达标检测,MgRCu等内容,欢迎下载使用。













