

高中人教版 (2019)第一节 硫及其化合物优秀学案及答案
展开硫及其化合物(1)
重难点 | 题型 | 分值 | |
重点 | 1. 了解硫的物理性质和化学性质 2. 掌握二氧化硫物理、化学性质 | 选择和填空 | 4-6分 |
难点 | 二氧化硫的化学性质 | ||
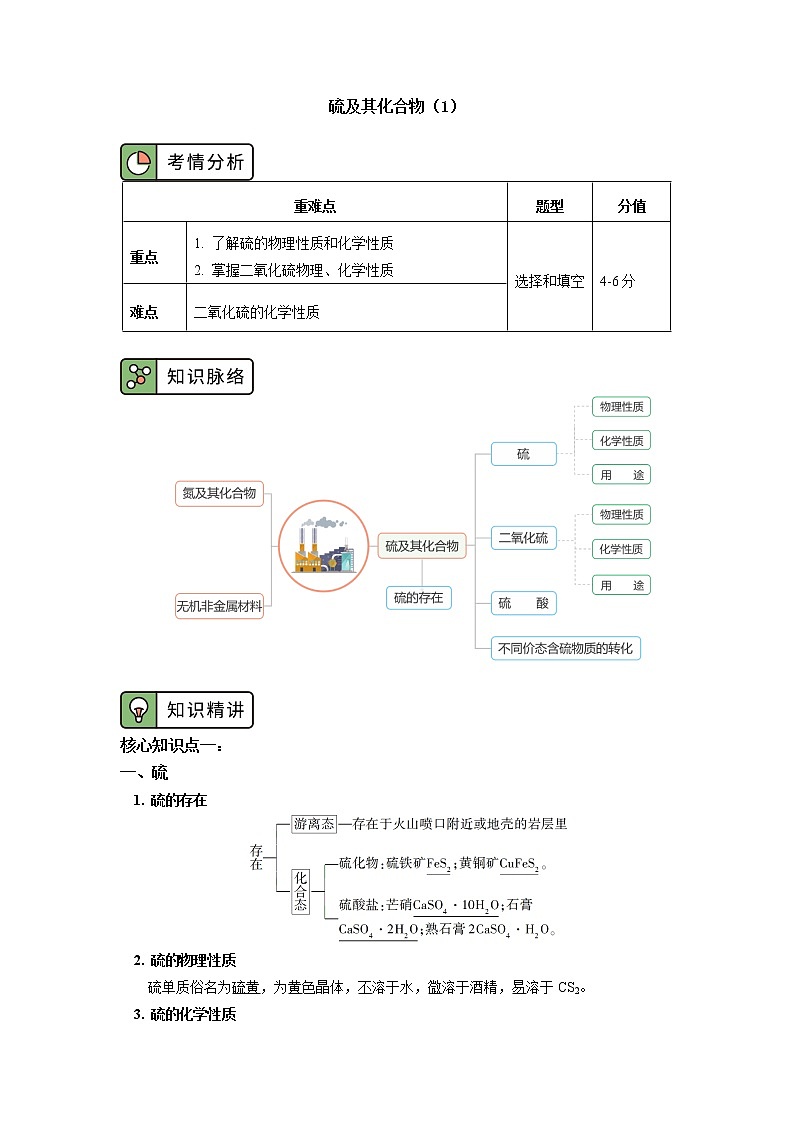
核心知识点一:
一、硫
1. 硫的存在
2. 硫的物理性质
硫单质俗名为硫黄,为黄色晶体,不溶于水,微溶于酒精,易溶于CS2。
3. 硫的化学性质
由于硫原子最外层有6个电子,比较活泼的非金属单质,常见化合价为-2,0,+4,+6,以下是常见的硫化物。
化合价 | -2 | 0 | +4 | +6 |
物质 类别 | FeS、Na2S、HgS、H2S | S | SO2、H2SO3、Na2SO3、NaHSO3 | SO3、H2SO4、NaHSO4、Na2SO4 |
可见,硫单质处于硫元素的中间价态,硫既有氧化性又有还原性。
(1)还原性:与O2反应:S+O2SO2。
(2)氧化性
①与Fe反应:Fe+SFeS;
②与Cu反应:2Cu+SCu2S;
③与Hg反应:S+Hg===HgS。
(3)与NaOH溶液的反应:3S+6NaOH2Na2S+Na2SO3+3H2O。
注意:①粘有硫的试管可以用CS2或热的碱液洗涤。
②硫与变价金属反应时生成低价态的金属硫化物,而不是高价态。如Fe与S反应生成FeS而不是Fe2S3。
4. 硫的用途
硫是重要的化工原料,比如可以制造硫化橡胶、火柴、药品等
核心知识点二:
二、二氧化硫
1. SO2物理性质
颜色 | 状态 | 气味 | 密度 | 溶解性 | 毒性 |
无色 | 气体 | 刺激性 气味 | 比空气 大 | 易溶 于水 | 有毒 |
2. SO2的化学性质
①酸性氧化物的通性
与H2O反应:,此反应为可逆反应。
与碱反应:SO2+2NaOH===Na2SO3+H2O。(SO2尾气处理的方法,此法是NaOH过量)
与碱性氧化物反应:SO2+CaO===CaSO3。
②还原性
与O2反应:,此反应为可逆反应。
③氧化性:SO2+2H2S===3S↓+2H2O
④漂白性:与某些有色物质(如品红)生成不稳定的无色物质,加热或久置可恢复原来的颜色。
注意:如果换做Na2O2与SO2反应,由于Na2O2有氧化性且不是碱性氧化物,所以两者在一起反应只发生氧化还原反应,生成物质为Na2SO4。
3. SO2的用途
①漂白纸浆、毛、丝、草帽辫等。
②用于杀菌消毒。
核心知识点一:
下列说法中错误的是( )
A. 自然界中硫是一种淡黄色难溶于水的固体
B. 硫的化合物常存在于火山喷出的气体中和矿泉水里
C. 硫与金属反应,生成金属的低价态化合物
D. 硫在空气中的燃烧产物是二氧化硫,纯氧中的燃烧产物是三氧化硫
【答案】D
【解析】A.硫是一种淡黄色、难溶于水的固体,A正确;B. 硫的化合物常存在于火山喷出的气体中和矿泉水里,多为二氧化硫,B正确;C. 硫的非金属性比较弱,硫与金属反应生成金属的低价态化合物,C正确;D. 硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物仍然是二氧化硫,D错误。答案选D。
【考点】硫的性质
关于硫的叙述正确的是( )
A. 硫的非金属性较强,在自然界中只以化合态存在
B. 可用水溶解过滤分离硝酸钾和硫黄的混合物
C. 硫与金属或非金属反应时都作氧化剂
D. 硫的氧化性比氯气强
【答案】B
【解析】硫在自然界中的存在形式既有化合态又有游离态;硝酸钾易溶于水,硫黄不溶于水,用水溶解过滤可分离二者的混合物;硫与金属、氢气等反应时作氧化剂,硫与氧气等反应时作还原剂;硫的氧化性比氯气弱(硫与铁反应生成硫化亚铁,氯气与铁反应生成氯化铁)。
【考点】硫的性质
核心知识点二:
向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成,此沉淀是( )
A. BaSO4 B. Fe2(SO4)3
C. BaSO3 D. S
【答案】A
【解析】Fe2(SO4)3不是沉淀,排除B项。题中隐含的条件为:该白色沉淀不溶于酸,可以排除C项。由Fe3+有氧化性,SO2有还原性,两者可发生氧化还原反应,硫元素化合价升高,生成的SO42-与Ba2+结合成BaSO4,根据该题的隐含信息,可写出下列化学方程式:2FeCl3+SO2+2H2O===2FeCl2+H2SO4+2HCl,BaCl2+H2SO4===BaSO4↓+2HCl。
【考点】二氧化硫的还原性
根据SO2通入不同溶液中的实验现象,所得结论不正确的是( )
选项 | 溶液 | 现象 | 结论 |
A | 含HCl、BaCl2的FeCl3溶液 | 产生白色沉淀 | SO2有还原性 |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 |
D | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
【答案】C
【解析】A对:SO2通入含HCl、BaCl2的FeCl3溶液中,发生反应:SO2 + 2Fe3+ +Ba2+ + 2H2O =BaSO4↓+ 2Fe2+ + 4H+,产生白色沉淀,该反应中SO2作还原剂,表现出还原性。B对:SO2通入H2S溶液中,发生反应:SO2+2H2S=3S↓+2H2O,产生黄色沉淀,该反应中SO2作氧化剂,表现出氧化性。C错:SO2通入酸性KMnO4溶液中,发生反应:5SO2+2 MnO4-+2H2O=5SO42-+2Mn2++4H+,该反应中,SO2作还原剂,表现出还原性而不是漂白性。D对:SO2通入Na2SiO3溶液中,发生反应:Na2SiO3+SO2+H2O=H2SiO3↓+Na2SO3,该反应符合“强酸制弱酸”的反应规律,则酸性:H2SO3>H2SiO3。
【考点】二氧化硫的化学性质
(答题时间:25分钟)
一、选择题
1. 下列物质在一定条件下能够与硫黄发生反应,且硫作还原剂的是( )
A. O2 B. Fe C. H2 D. Zn
2. 常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温度达到750 ℃时,硫蒸气主要以S2形式存在(占92%)。下列说法中正确的是( )
A. S8转化为S6、S4、S2属于物理变化
B. 不论哪种硫分子,完全燃烧时都生成二氧化硫
C. S2、S4、S6、S8都是硫元素形成的单质,为同种物质
D. 把硫单质在空气中加热到750 ℃即得S2
3. 大约4000年前,埃及人已经用硫燃烧所形成的二氧化硫漂白布匹。在古罗马著名诗人荷马的著作里讲到硫燃烧有消毒和漂白作用。下列物质都具有漂白性:①潮湿的氯气、②二氧化硫、③活性炭、④过氧化钠,其漂白原理相同的是( )
A. ①③B. ②③C. ①④D. ②④
4. 下列有关SO3的说法中正确的是( )
A. SO3极易溶于水,且与水反应生成H2SO4
B. 标准状况下,1 mol SO3的体积约为22.4 L
C. 硫粉在过量的纯氧中燃烧可以生成SO3
D. SO2、SO3均具有漂白性,均能使紫色石蕊溶液褪色
5. 下列物质能将品红氧化使品红溶液褪色的是( )
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤臭氧
A. ①②③④⑤ B. ②③④⑤
C. ②③④ D. ②③⑤
6. 下列关于SO2变化和其相应性质对应关系不正确的是( )
A. 使品红溶液褪色——漂白性
B. 导致酸雨——酸性氧化物
C. 使高锰酸钾溶液褪色——漂白性
D. 通入H2S溶液中变浑浊——氧化性
7. 用下图所示实验装置进行SO2性质的探究实验。
(1)装置A中发生反应的离子方程式为__________,G装置的作用_____________。
(2)简述检查该装置气密性的方法________________________________。
(3)能够证明SO2具有还原性、氧化性的实验装置依次为_______和________(用字母表示),观察到的现象依次是_____________________、____________________。
(4)若要证明酸性:H2CO3>H2SiO3,则应观察到的实验现象有_______________。
1. 【答案】A
【解析】硫是较活泼的非金属元素,能与许多金属、非金属发生反应。硫与活泼非金属单质氧气反应时,表现出还原性;硫与金属单质、氢气等反应时,表现出氧化性;硫与变价金属反应时,一般生成低价金属的硫化物。
2.【答案】B
【解析】硫单质之间的转化为化学变化,A不正确;不论哪种硫分子,完全燃烧的产物均为二氧化硫,B正确;S2、S4、S6、S8都是硫元素形成的单质,但是,构成分子的原子数不同,不是同种物质,C不正确;硫单质在空气中加热会燃烧生成二氧化硫,不可能与S2相互转化,D不正确。
3.【答案】C
【解析】潮湿的氯气(有次氯酸生成)、过氧化钠都是强氧化型漂白;二氧化硫是化合型漂白;活性炭是吸附型漂白。
4.【答案】A
【解析】SO3溶于水发生反应:SO3+H2O===H2SO4,A正确;标准状况下,SO3呈固态并非气态,体积远远小于22.4 L,B错误;不管氧气量有多少,硫在氧气中燃烧的产物都是SO2,C错误;SO2具有漂白性,但不能使紫色石蕊溶液褪色,SO3不具有漂白性,D错误。
5.【答案】D
【解析】活性炭具有吸附性,不是氧化性,①错误;过氧化钠具有强氧化性,能把品红溶液氧化而褪色,②正确;氯水具有强氧化性,能把品红溶液氧化而褪色,③正确;二氧化硫使品红溶液褪色的原理不是氧化,④错误;臭氧具有强氧化性,能把品红溶液氧化而褪色,⑤正确。
6.【答案】C
【解析】SO2具有漂白性,能使品红溶液褪色,但是不能漂白酸碱指示剂;SO2具有酸性氧化物的通性,能够与水反应生成亚硫酸,在空气中氧化为硫酸,随雨水落下形成酸雨;SO2具有还原性,能使高锰酸钾溶液褪色;SO2中的硫元素化合价处于+4价,具有弱氧化性,能氧化H2S:2H2S+SO2===3S↓+2H2O。故选C。
7.【答案】(1)HSO+H+===SO2↑+H2O 吸收尾气,防止CO2进入F
(2)G中加水至没过导管口,微热A中圆底烧瓶,若G中有气泡产生,停止加热,冷却后导管末端形成一段水柱,说明气密性良好
(3)C B C中溴水褪色 B中出现淡黄色沉淀
(4)E中品红不褪色,F中出现浑浊
【解析】(1)A中浓硫酸与亚硫酸氢钠反应生成二氧化硫气体和水,反应的离子方程式为HSO+H+===SO2↑+H2O;SO2属于污染空气的气体,不能排放到大气中,空气中的CO2气体也会和F中的Na2SiO3溶液反应生成白色沉淀,所以G装置的作用是吸收尾气,防止CO2进入F。(3)SO2能与溴水发生反应,化学方程式为SO2+Br2+2H2O===2HBr+H2SO4,S元素由+4价升高到+6价,体现了SO2的还原性,SO2能与Na2S发生反应,化学方程式为SO2+2Na2S+2H2O===3S↓+4NaOH,该反应SO2中的硫元素由+4价降低到0价,体现了SO2的氧化性,则能够证明SO2具有还原性、氧化性的实验装置依次为C和B,观察到的现象依次是C中溴水褪色,B中出现淡黄色沉淀。(4)D装置能生成CO2,根据“强酸制弱酸”原理,CO2和SO2都能和Na2SiO3溶液反应生成白色沉淀,需要先验证SO2被除去,然后再验证酸性H2CO3>H2SiO3,所以若要证明酸性:H2CO3>H2SiO3,则应观察到的实验现象有E中品红不褪色,F中出现浑浊。
高中化学人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第一节 硫及其化合物学案: 这是一份高中化学人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第一节 硫及其化合物学案,共10页。学案主要包含了硫元素的存在和硫单质的性质,二氧化硫,亚硫酸,二氧化硫的化学性质,二氧化硫对环境的污染等内容,欢迎下载使用。
人教版 (2019)必修 第二册第一节 硫及其化合物学案设计: 这是一份人教版 (2019)必修 第二册第一节 硫及其化合物学案设计,共24页。学案主要包含了学时安排,学习目标,学习重难点,学习过程,情境·思考,重难点突破,案例示范,迁移·应用等内容,欢迎下载使用。
化学必修 第二册第一节 硫及其化合物导学案: 这是一份化学必修 第二册第一节 硫及其化合物导学案,共24页。学案主要包含了学时安排,学习目标,学习重难点,学习过程,情境·思考,重难点突破,案例示范,迁移·应用等内容,欢迎下载使用。