




九年级下册第九单元 溶液综合与测试复习课件ppt
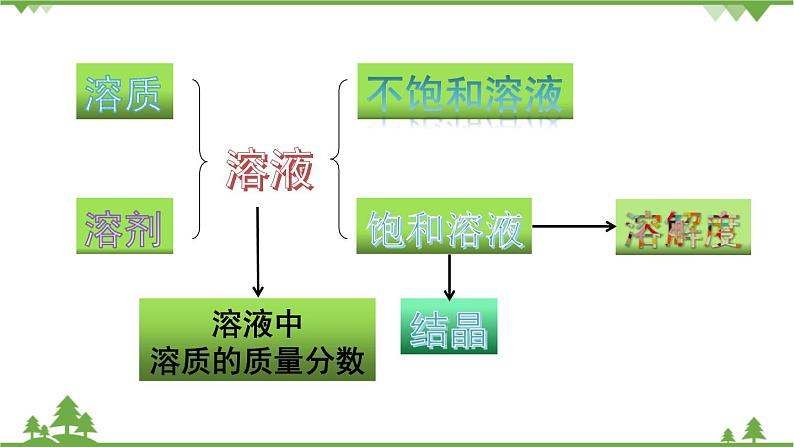
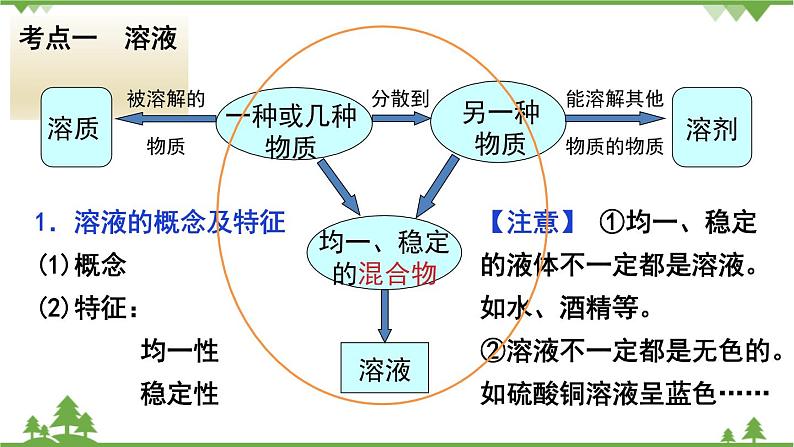
展开均一、稳定 的混合物
能溶解其他 物质的物质
1.溶液的概念及特征(1)概念(2)特征: 均一性 稳定性
【注意】 ①均一、稳定的液体不一定都是溶液。如水、酒精等。②溶液不一定都是无色的。如硫酸铜溶液呈蓝色……
③溶液中未溶解的部分不能视为溶质。④与水发生反应的物质,放入水中时,生成物为该溶液的溶质,如CaO放入水中时,溶质是Ca(OH)2,而不是CaO。
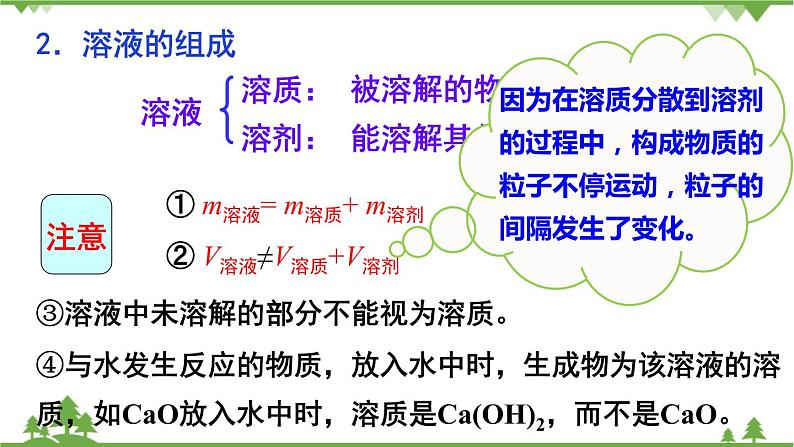
① m溶液= m溶质+ m溶剂
② V溶液≠V溶质+V溶剂
因为在溶质分散到溶剂的过程中,构成物质的粒子不停运动,粒子的间隔发生了变化。
物质在溶解时常伴随有吸热、放热现象。如________溶解时会吸热,表现为溶液的温度降低;________溶解时会放热,表现为溶液的温度升高;_________溶于水时溶液的温度基本不变。
3.溶解时的吸热、放热现象
①物质溶于水后,往往会使溶液的沸点、凝固点、密度等发生变化。
②氧化钙遇水也会放出大量的热,但这一过程并非溶解放热,而是氧化钙与水反应放出的热。
当在植物油中加入洗涤剂后振荡,植物油就被分散成无数细小的油滴,而不能聚集成大的油珠,这种现象被称为_________。肥皂、洗涤剂等都具有乳化作用。
【注意】乳化与溶解的不同点在于,分散的物质在水中存在的状态不同。植物油被乳化后变成无数细小的油滴分散在水中,较稳定,但不是非常均匀;而溶质溶解在水中,是以分子或离子的形式存在的,具有均一、稳定的特征。
【练习1】(海南中考)下列厨房用品在水中能形成溶液的是( ) A.芝麻油 B.面粉 C.蔗糖 D.黄豆酱
【练习2】(湖北宜昌中考)下列物质溶于水的过程中,溶液温度会明显降低的是() A.氯化钠B.硝酸铵 C.浓硫酸D.氢氧化钠
【练习3】(湖北天门中考)下列有关溶液的叙述错误的是( )A.长期放置后不会分层的液体一定是溶液B.衣服上的油污用汽油或用加了洗涤剂的水可除去C.一瓶合格的生理盐水密封一段时间,不会出现浑浊D.实验室常将固体药品配制成溶液进行化学反应,以提高反应速率
考点二 饱和溶液与不饱和溶液
在一定温度下,在一定量的溶剂里,不能再继续溶解某种溶质的溶液
在一定温度下,在一定量的溶剂里,还能继续溶解某种溶质的溶液
增加溶剂、升高温度
加入溶质、蒸发溶剂、降低温度
饱和溶液 不饱和溶液
①某物质的饱和溶液是指相应的溶质不能继续溶解的溶液,但还可以溶解其他物质。如饱和食盐水还可以继续溶解硝酸钾固体。
②通过降低温度实现由不饱和溶液向饱和溶液的转化,只是针对多数固体溶质而言,对气体和少数固体(如熟石灰)等不适用。
③对某饱和溶液进行降温或蒸发溶剂时,往往会有溶质从溶液中以晶体形式析出。
4、浓、稀溶液与饱和不饱和溶液之间的关系①饱和溶液不一定是浓溶液②不饱和溶液不一定是稀溶液,如饱和的石灰水溶液就是稀溶液③在一定温度时,同一种溶质的饱和溶液一定要比它的不饱和溶液浓5、混合物的分离(1)过滤法:分离可溶物 + 难溶物(2)结晶法:分离几种可溶性物质结晶的两种方法 ①蒸发结晶(蒸发溶剂):适用于得到溶解度受温度影响较小的物质。如NaCl(海水晒盐)②降温结晶(冷却热饱和溶液):适用于得到溶解度随温度升高而升高的物质,如KNO3
【练习4】(浙江义乌中考)某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是( ) A.②中溶液是饱和溶液 B.③中溶液一定是不饱和溶液 C.②③中溶液的溶质质量分数不相同 D.③中溶液的溶质质量大于②中溶液的溶质质量
考点三 溶解度及溶解度曲线
(1)概念:在___________下,某固态物质在______g 溶剂里达到______状态时所溶解的______,叫作这种物质在这种溶剂里的溶解度。如果不指明溶剂,通常所说的溶解度是指物质在水中的溶解度。(2)影响因素①内因:溶质和溶剂的性质;②外因:主要是________。
溶解度与溶解性(通常状态下)
2.气体的溶解度(1)概念:是指在一定温度下,压强为________ 时,某气体溶解在_____体积的水里达到________状态时的气体________。(2)影响因素:①内因:气体的性质。②外因:主要是温度和压强。温度越高,气体的溶解度_______;压强越大,气体的溶解度______。
3.溶解度曲线(1)概念:指溶解度随温度变化的曲线。横坐标表示________,纵坐标表示__________。
大多数固体物质的溶解度随温度的升高而增大,如_______;
少数固体物质的溶解度受温度的影响很小,如________;
极少数固体物质的溶解度随温度的升高而减小,如________。
(2)含义:①曲线上的点表示某物质的饱和溶液;②曲线的走向表示某物质的溶解度随温度的变化趋势;③两条曲线的交点表示两种溶质在交点对应温度下的溶解度相同。
(4)溶解度曲线常见的考查形式(如图)
①t3℃时,a的溶解度为________g。②P点的含义是_________________________。
t2℃时,a和c的溶解度相等
③N点对应的溶液为t3℃时a的__________溶液,可通过____________________________________等方法使a的不饱和溶液变成饱和溶液。④t1℃时,a、b、c三种物质的溶解度由大到小的顺序为______________。
加入a物质(或降温,或恒温蒸发溶剂)
⑤从a溶液中获取a晶体可采用__________________的方法。⑥从b溶液中获取b晶体可采用__________________的方法。
⑦t2℃时,a、b、c三种物质的饱和溶液各w g,降温至t1℃会析出晶体的是__________,此时所得溶液中溶质的质量分数由小到大的顺序是_________。⑧分离a与少量b 的混合物,可采用_____________的方法。
考点四 溶质的质量分数
1.定义:溶质质量与溶液质量之比
①质量单位要统一②既适用于饱和溶液的计算,也适用于不饱和溶液的计算。③溶质的质量分数一般用百分数来表示,不能用分数表示。④未溶解的物质不能计入溶质质量。
2.一定温度下,某物质饱和溶液的溶质质量分数
点拨:一定温度下,某饱和溶液的溶质质量分数为定值。
3.关于溶液稀释问题的计算
溶液稀释前后,溶质的质量不变
点拨:溶质质量 = 溶液质量 × 溶质的质量分数
【例1】(新疆中考)某化学兴趣小组取12.5g的 大理石样品(杂质不与盐酸反应)加入到一定量的稀盐酸中,产生CO2的质量与稀盐酸的质量关系如图所示。请计算:(1)生成CO2的质量是_____g;(2)该盐酸的溶质质量分数是多少?(列式计算,计算结果保留到0.1%)
(2)解:设该盐酸中溶质的质量为x。
73 44 x 4.4g
盐酸的溶质质量分数 =
答:该盐酸的溶质质量分数是7.3%。
CaCO3+2HCl==CaCl2+H2O+CO2↑
考点五 一定溶质质量分数溶液的配制
配制50 g溶质质量分数为5%的氯化钠溶液
仪器:托盘天平(砝码盒)、量筒(10mL、50mL、100mL)、___________、烧杯、________、________、擦拭纸、称量纸。步骤:①计算:需氯化钠的质量为_____,需水的体积为_______②称量:分别在托盘天平左右两盘放上相同的称量纸,调节托盘天平平衡后,先将游码移动至______,然后逐渐往_____盘加氯化钠固体至天平平衡。
③量取:用________的量筒量取________的水。④溶解:用玻璃棒搅拌的目的是________________,溶解时________(填“能”或“不能”)在量筒中进行。⑤装瓶贴标签。
【练习5】(陕西中考)规范的实验操作是实验成功的关键。下列配制20 g 10%的氯化钠溶液的操作中不规范的是()
初中化学人教版九年级下册课题3 溶液的浓度教学ppt课件: 这是一份初中化学人教版九年级下册课题3 溶液的浓度教学ppt课件,共20页。PPT课件主要包含了硫酸铜溶液,溶液的浓度,一溶质质量分数,合作探究1,合作探究2,谈体会说收获,练一练等内容,欢迎下载使用。
人教版中考化学复习第九单元溶液教学课件: 这是一份人教版中考化学复习第九单元溶液教学课件,共39页。PPT课件主要包含了混合物,被溶解,几乎不溶解,溶解性是不同的,不同的,NH4NO3,NaOH,NaCl,乳化作用,托盘天平等内容,欢迎下载使用。
人教版中考化学复习第九单元溶液练习课件: 这是一份人教版中考化学复习第九单元溶液练习课件,共42页。PPT课件主要包含了增加溶质或蒸发溶,剂或降低温度,氢氧化钙,搅拌加速溶解,HCl,abc等内容,欢迎下载使用。














