



人教版九年级下册课题3 溶液的浓度备课课件ppt
展开淡蓝 蓝色 深蓝
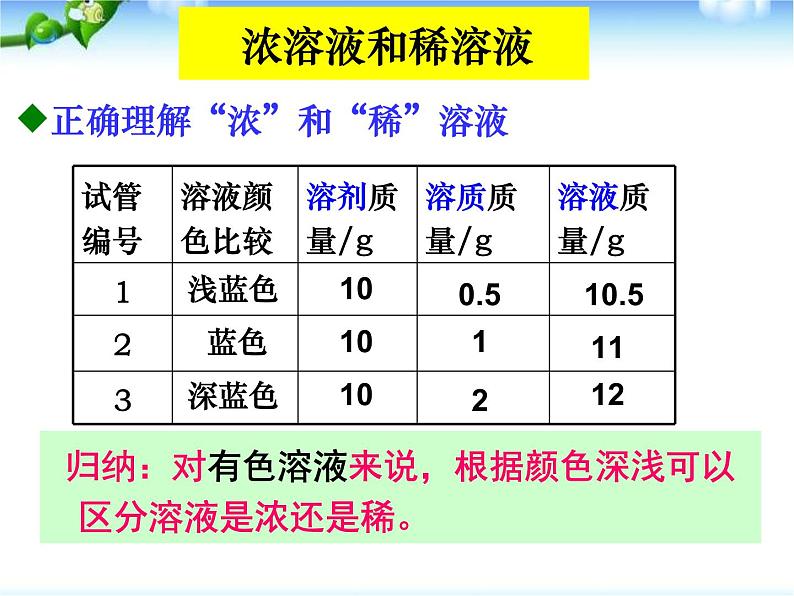
浓溶液和稀溶液
正确理解“浓”和“稀”溶液
归纳:对有色溶液来说,根据颜色深浅可以区分溶液是浓还是稀。
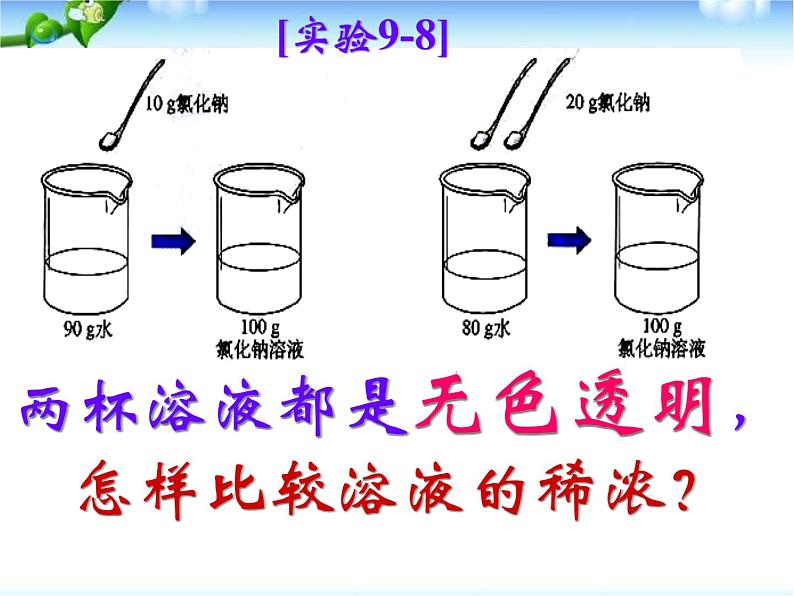
两杯溶液都是无色透明,怎样比较溶液的稀浓?
药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木.
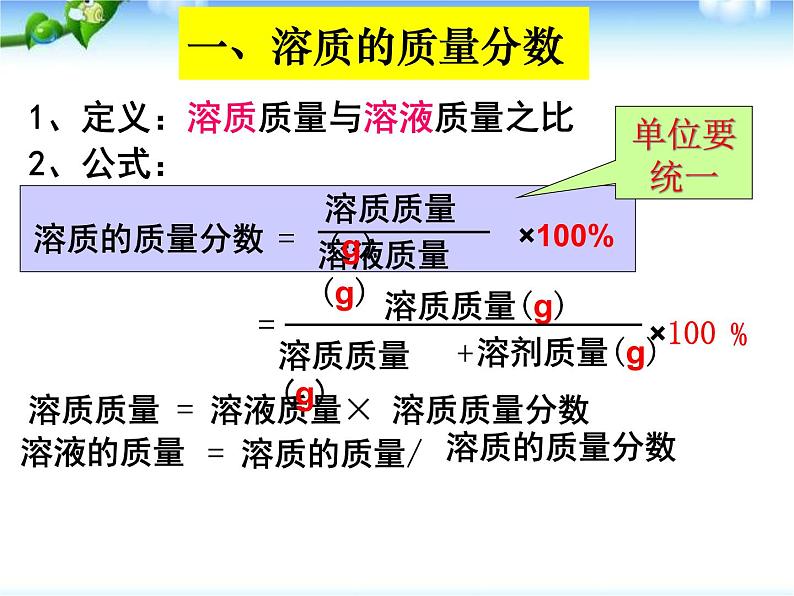
1、定义:溶质质量与溶液质量之比
溶质质量 = 溶液质量× 溶质质量分数
定义:溶质的质量与溶液的质量之比。(通常以百分数表示)
注意:①溶质的质量:溶于溶剂的才是溶质,不溶的固体不能计算在内。②溶液的质量 = 溶质的质量 + 溶剂的质量。 (必须分清溶质、溶剂与溶液)。 ③计算时上下质量单位要统一。④不要忘记X100%,最后得到百分数。
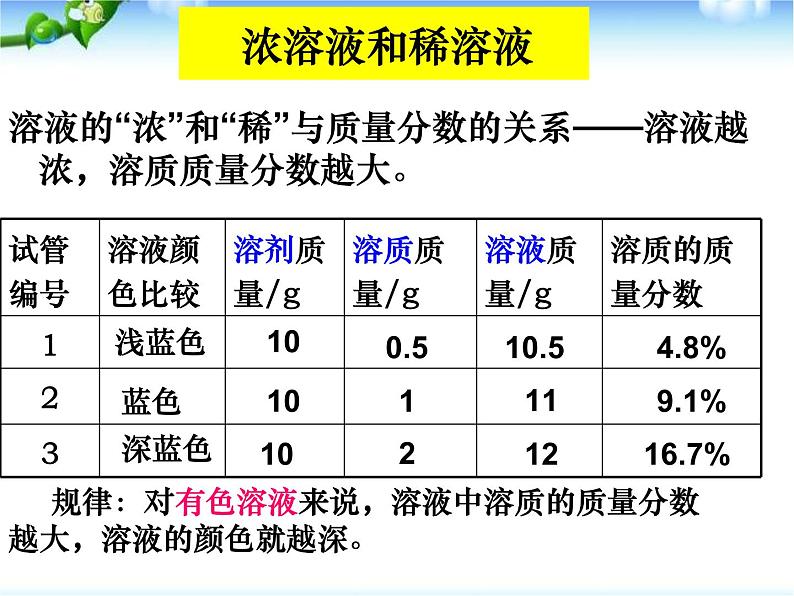
溶液的“浓”和“稀”与质量分数的关系——溶液越浓,溶质质量分数越大。
规律:对有色溶液来说,溶液中溶质的质量分数越大,溶液的颜色就越深。
讨论:按下表所定的量配制氯化钠溶液
1.溶液饱和与否与浓稀没有必然联系,即浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液。
2.相同温度下,同种物质的溶液,饱和的比不饱和的溶液浓。
3.用浓稀溶液不能准确的表示一定量的溶液里溶质的多少。实际应用时,通常需要准确知道一定量的溶液里溶质的量——即溶液组成的确切表示。
4. 溶液组成的表示方法很多,通常用溶液中溶质的质量分数来表示溶液的组成。
3、有关溶质质量分数的计算
例2:从一瓶氯化钾的溶液中取出35g溶液蒸干后得到7g氯化钾固体,求这瓶溶液溶质的质量分数。
答:这瓶溶液中氯化钾的质量分数为28.6%
例1:20g10%的食盐水中倒出一半,求:剩余溶液的溶质的质量分数。
剩余溶液的溶质质量分数不变,仍是10 %
例3、在农业上,常需要用质量分数为16%的氯化钠溶液来选种。配制150kg这种溶液,需要氯化钠和水的质量各是多少?
150kg×16%=24kg
150kg-24kg=126kg
答:需食盐24kg,水126kg。
练习:用4.5g食盐可配制0.9%的生理食盐水多 少克?
例4、18g10%的食盐水中分别放入2g水或2g食盐,求:所得溶液的溶质质量分数。
18g X10%+2g
4、饱和溶液溶质质量分数的计算
溶质的质量分数36% 是指:100g溶液中含有36g溶质。 溶质T0C时溶解度36g是指:在T0C 时,100g溶剂中最多溶解该溶质36g。
T0C时饱和溶液的溶质质量分数 =
溶解度(g)
100g+溶解度(g)
某温度下某物质的溶解度为ag,则同温下它的饱和溶液中溶质质量分数_____a%(填大于,小于或等于)
练习1:已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。
解:20℃时食盐饱和溶液的溶质质量分数为
5、关于溶液稀释的计算
例:化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸,需要多少克水?
解:设需要水的质量为 50g 98%=(50g + )20% =195g
答:需要加水的质量为195g。
计算原理:溶液稀释前后,溶质的质量不变
【解】设:稀释后溶液的质量为X。
100g × 98% = X × 10%
需要水的质量 = 980g - 100g = 880g
答:需要水的质量为880g。
练习:1(课本P45)把100g质量分数为98%的浓硫酸 稀释成10%的稀硫酸,需要水的质量是多少?
(一)实验步骤: 1.计算 2.称量、量取 3.溶解 4.装瓶
例1: (溶质为固体)配制50g 6%的食盐水
1.计算:需食盐50g×6%=3g 需水50g–3g=47g 47g÷1g/mL= 47mL
2.称量:用天平称量3g食盐,量取:用量筒量取47mL水
3.溶解:用玻璃棒搅拌使其完全溶解
(二)实验仪器: 药匙、托盘天平、量筒、胶头滴管、烧杯、玻璃棒
4.装瓶:(盖好瓶塞贴上标签)
二、溶 液 的 配 制
练习: 下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的5处错误,并说明理由。
二、配制质量分数为3%的氯化钠溶液
用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。
6%的氯化钠溶液 g(体积 mL );水 g。
用量筒量取24mL的6%氯化钠溶液和25mL的水,倒入烧杯中。
用玻璃棒搅拌,使溶液混合均匀。
三、把配制好的上述两种氯化钠溶液分别装入试剂瓶中, 盖好瓶塞并贴上标签(标签中应包括药品名称和溶液 中溶质的质量分数),放到试剂柜中。
50g×3%÷6%=25g
25g÷1.04g/cm3=24mL
50g-25g=25g
导致溶液的溶质质量分数偏小的原因:1、天平使用不正确,如药品、砝码放反(称量时使用游码),使药品称量质量偏小。2、量取水的过程中仰视读数,使水量取多了。3、烧杯不干燥,原来内部就有一些水。4、固体药品中含有杂质等。
导致溶液的溶质质量分数偏大的原因:1、天平使用不正确,如称量前没有调平衡,指针偏右,导致药品称量偏多。2、砝码已生锈。3、量取水的过程中俯视读数,使水量取少了。4、将量筒中的水倒入烧杯时,一部分洒在外面等。
例:13g锌粒与100g稀硫酸恰好完全反应,求稀硫酸中溶质的质量分数?
解:设H2SO4的质量为x
Zn + H2SO4 = ZnSO4 + H2↑
答:稀硫酸的质量分数为19.6%。
补充练习:溶液与化学方程式的混合计算
【解】 :盐酸中溶质的质量为:73g×20% = 14.6g
【课本P45】6 73g质量分数为20%的盐酸与足量大理石反应,生成二氧化碳的质量是多少?这些二氧化碳的体积(标准状况)是多少?(在标准状况下,CO2的密度为1.977g/L。)
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
设生成二氧化碳的质量为X
73 44
14.6g X
二氧化碳的体积 = 8.8g÷1.977g/L = 4.45L
答:CO2的质量为8.8g;CO2的体积为4.45L
练习:6.5g锌和100g一定质量分数的稀硫酸恰好完全反应,求:(1)生成氢气的质量?(2)稀硫酸中溶质的质量分数?(3)生成的硫酸锌溶液中溶质的质量分数?
解:设生成氢气的质量为x,硫酸的质量为y,生成硫酸锌的质量为z
Zn+H2SO4 == ZnSO4+H2↑ 65 98 161 2 6.5g y z x
X=0.2g y=9.8g z=16.1g
生成的硫酸锌溶液中溶质的质量分数为:
答:生成氢气0.2g,稀硫酸中溶质的质量分数为9.8%,生成的硫酸锌溶液溶质的质量分数为15.15%。
初中人教版课题3 溶液的浓度教学演示课件ppt: 这是一份初中人教版课题3 溶液的浓度教学演示课件ppt,共27页。PPT课件主要包含了各加入20ml水,比较颜色,浅蓝色--→深蓝色,稀----→浓,发现什么,葡萄糖注射液的浓度,溶质的质量分数,计算公式,注意公式推导,溶质质量分数的含义等内容,欢迎下载使用。
人教版九年级下册课题3 溶液的浓度一等奖ppt课件: 这是一份人教版九年级下册课题3 溶液的浓度一等奖ppt课件,共33页。PPT课件主要包含了新课导入,颜色的深浅,溶液的浓度,溶质的质量分数,一溶质的质量分数,X=150g,溶液稀释问题的计算,x50g,溶液浓缩的计算,x196g等内容,欢迎下载使用。
初中化学课题3 溶液的浓度公开课课件ppt: 这是一份初中化学课题3 溶液的浓度公开课课件ppt,共22页。PPT课件主要包含了新课导入,颜色的深浅,P42,实验探究,淡蓝色,溶质的质量分数,举一反三,溶液的质量分数,P43,都是10%等内容,欢迎下载使用。













