




苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第三单元 盐类的水解获奖ppt课件
展开1.认识盐类水解有一定限度,理解盐类水解的概念,能正确书写盐类水解的离子方程式和化学方程式。2.通过实验分析、推理等方法认识盐类水解的实质,掌握盐溶液呈酸、碱性的原因和规律,能根据盐的组成判断溶液的酸、碱性。
绣球花有“酸蓝碱红”的开花规律
硫酸铝Al2(SO4)3
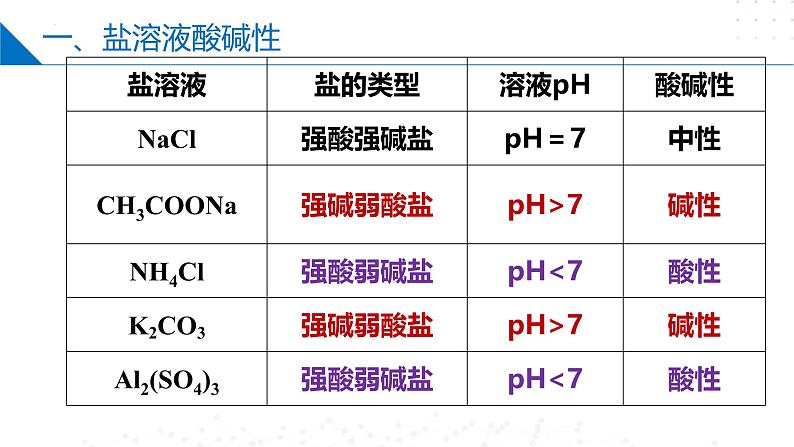
选择合适的方法测试下表所列盐溶液的酸碱性。
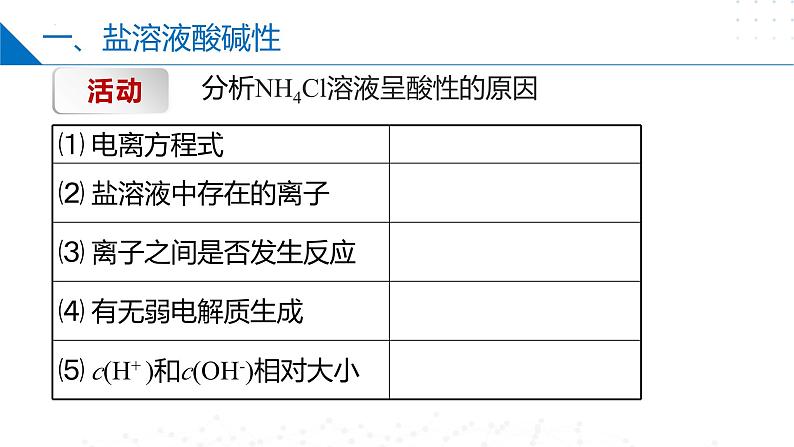
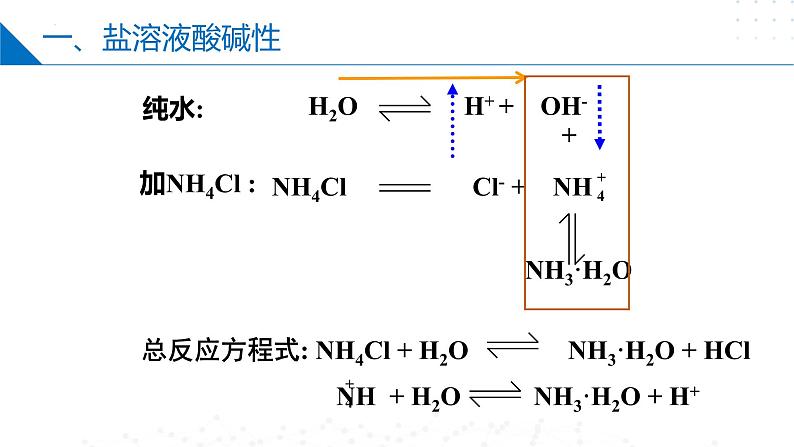
分析NH4Cl溶液呈酸性的原因
分析CH3COONa溶液呈酸性的原因
分析NaCl溶液呈中性的原因
Na+、Cl-、H+、OH-
c(H+)=c(OH-)
盐在水溶液中电离出的离子与水电离出的H+或OH-结合生成弱电解质的反应。
生成弱电解质,破坏、促进水的电离。
盐 + 水 酸 + 碱
水解反应可以看成酸碱中和反应的逆反应,是吸热反应
多元弱酸盐水解是分步的,但以第一步为主
——盐中有弱酸根离子或弱碱阳离子才水解,若没有,则是强酸强碱盐,不发生水解反应。
有弱才水解,无弱不水解
NH4+、金属活动性顺序表Na之后的金属阳离子,如Mg2+、Al3+、Fe3+等。
CO32-、HCO3-、SO32-、HSO3-、S2-、HS-、ClO-、SiO32-、CH3COO-、F-、AlO2-等。
——弱酸弱碱盐电离出的弱酸根离子和弱碱阳离子都发生水解,且相互促进。
——弱酸根离子对应的酸越弱,水解程度越大;弱碱阳离子对应的碱越弱,其水解程度越大。
如醋酸的酸性强于次氯酸,
则相同浓度的CH3COONa的水解程度小于NaClO。
——①强酸强碱盐溶液显中性;——②盐中的阳离子对应的碱的电离常数Kb与盐中的阴离子对应的酸的电离常数Ka相等时,盐溶液呈中性。
CH3COONH4溶液呈中性。
——即强酸弱碱盐显酸性,强碱弱酸盐显碱性。
如HF的电离常数大于NH3•H2O的电离常数,故NH4F溶液呈酸性。
例1 已知一些酸在常温下的电离平衡常数如表所示:
常温下,0.1 ml•L-1的下列溶液,pH最大的是( )A.Na2C2O4 B.NaHCO3C.NaClO D.CH3COONa
盐类水解程度一般很小,水解时通常不生成沉淀和气体,书写水解的离子方程式时,一般用“⇌”连接,产物不标“↑”或“↓”。
ClO-+H2O ⇌HClO+OH-
NH4++H2O ⇌NH3·H2O+H+
盐类水解离子方程式的书写
多元弱酸根离子的水解分步进行,第一步水解远大于第二步水解,水解以第一步为主。
HCO32-+H2O ⇌H2CO3+OH-
CO32-+H2O ⇌ HCO32-+OH-
多元弱碱阳离子水解反应过程复杂,只要求一步写到底。
Al3++3H2O ⇌ Al(OH)3+3H+
弱酸弱碱盐中阴、阳离子水解相互促进。
1、NH4+与S2-、HCO3-、CO32-、CH3COO-等组成的盐虽然水解相互促进,但水解程度较小,书写时仍用“⇌”表示。
NH4++CH3COO-+H2O⇌CH3COOH+NH3·H2O。
2、Al3+与CO32-、HCO3-、S2-、HS-、AlO2-,Fe3+与CO32-、HCO3-等组成的盐水解相互促进非常彻底,生成气体和沉淀,书写时用“===”表示。
Al3++3HCO3-===Al(OH)3↓+3CO2↑。
(一般要有弱碱沉淀生成)
盐类水解离子方程式与其电离方程式辨别的关键:
如H3O+―→H2O+H+
HS-+H2O ⇌S2-+H3O+⇒HS-⇌S2-+H+
HS-+H2O ⇌H2S+OH-
例2 下列属于水解的离子方程式且书写正确的是( )A.HS-+H2O H3O++S2-B.Fe3++3H2O Fe(OH)3↓+3H+C.SO +2H2O H2SO3+2OH-D.Al3++3HCO ===Al(OH)3↓+3CO2↑
弱酸的酸式酸根离子在水溶液中存在电离平衡和水解平衡,弱酸酸式盐溶液的酸碱性取决于其电离程度和水解程度的相对大小。
水解程度大于电离程度:如呈碱性的NaHCO3、NaHS、Na2HPO4溶液。
电离程度大于水解程度:如呈酸性的NaHSO3、KHC2O4、NaH2PO4溶液。
只电离不水解的显酸性:如NaHSO4
例3 室温下,物质的量浓度相同的下列溶液,按pH由小到大的顺序排列的是( )A.Na2CO3、NaHCO3、NaCl、NH4ClB.Na2CO3、NaHCO3、NH4Cl、NaClC.(NH4)2SO4、NH4Cl、NaNO3、Na2SD.NH4Cl、(NH4)2SO4、Na2S、NaNO3
盐溶液酸碱性盐溶液不同酸碱性的原因
盐类水解原理盐类水解规律水解离子方程式书写溶液酸碱度比较
1.下列操作会使H2O的电离平衡向正反应方向移动,且所得溶液呈酸性的是( )A.向水中加入少量的CH3COONaB.向水中加入少量的NaHSO4C.加热水至100 ℃,pH=6D.向水中加少量的明矾
2.有pH分别为8、9、10的三种相同物质的量浓度的盐溶液NaA、NaB、NaC,以下说法中不正确的是( )A.在三种酸HA、HB、HC中HC酸性相对最弱B.中和1 ml三种酸,需要的NaOH均为1 mlC.在A-、B-、C-中,A-结合H+的能力最强D.HA、HB、HC均为弱酸
高中苏教版 (2019)第三单元 盐类的水解完美版ppt课件: 这是一份高中苏教版 (2019)<a href="/hx/tb_c4009322_t3/?tag_id=26" target="_blank">第三单元 盐类的水解完美版ppt课件</a>,文件包含332影响盐类水解的因素盐类水解的应用同步课件pptx、硫酸铝的理化性质和用途00_00_00-00_03_21mp4等2份课件配套教学资源,其中PPT共30页, 欢迎下载使用。
苏教版 (2019)选择性必修1第三单元 盐类的水解说课课件ppt: 这是一份苏教版 (2019)选择性必修1<a href="/hx/tb_c4009322_t3/?tag_id=26" target="_blank">第三单元 盐类的水解说课课件ppt</a>,文件包含331盐类水解的原理同步课件-2023-2024学年高二化学同步精品课堂苏教版2019选择性必修第一册pptx、给绣球花“调色”分为3个步骤少了一个颜色都会变化mp4等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解评课ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1<a href="/hx/tb_c4009322_t3/?tag_id=26" target="_blank">第三单元 盐类的水解评课ppt课件</a>,共1页。













