



苏教版 (2019)选择性必修1第三单元 盐类的水解背景图课件ppt
展开1.理解盐类水解的实质。2.能运用盐类水解的规律判断盐溶液的酸碱性。3.能够正确书写盐类水解的离子方程式。
1.根据形成该盐的酸和碱的强弱,对盐分类填空。2.如何测定下列盐溶液的酸碱性?3.选择合适的实验方法测定下列盐溶液的酸碱性。
中性 碱性 酸性 碱性 酸性
1.将NaCl溶解在水中,分析发生了哪些过程?是否对水的电离平衡产生影响?
NaCl=== Na+ + Cl-
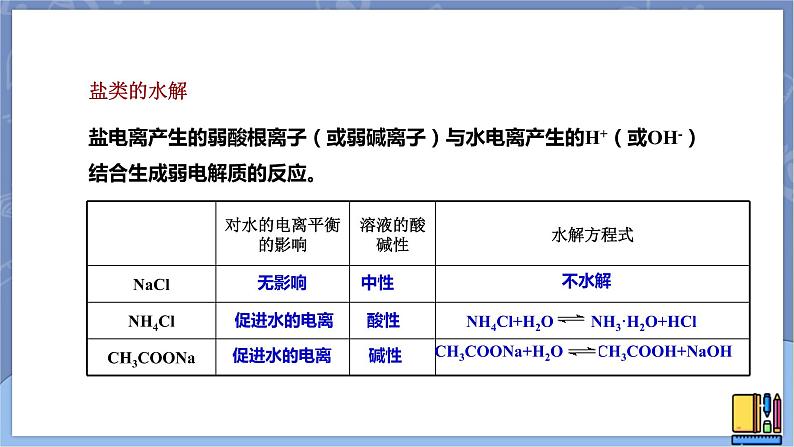
Na+是强碱离子,不与OH-结合;Cl-是强酸根离子,不与H+结合;对水的电离平衡无影响。
强酸强碱盐溶于水后,溶液显中性。
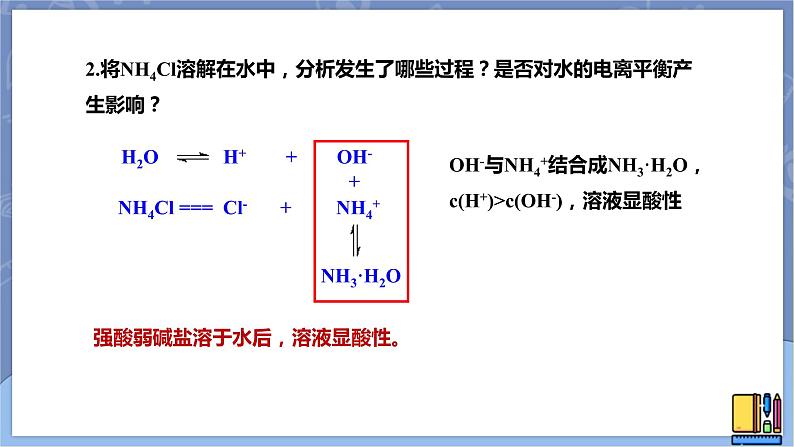
2.将NH4Cl溶解在水中,分析发生了哪些过程?是否对水的电离平衡产生影响?
NH4Cl === Cl- + NH4+
OH-与NH4+结合成NH3·H2O,c(H+)>c(OH-),溶液显酸性
强酸弱碱盐溶于水后,溶液显酸性。
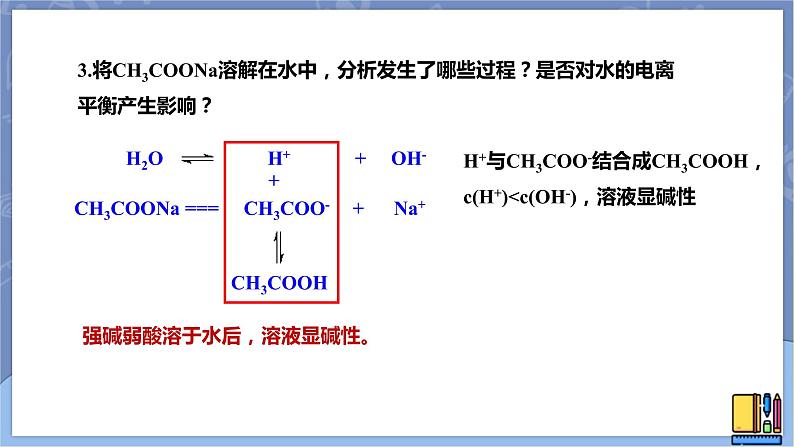
3.将CH3COONa溶解在水中,分析发生了哪些过程?是否对水的电离平衡产生影响?
CH3COONa === CH3COO- + Na+
H+与CH3COO-结合成CH3COOH,c(H+)
盐电离产生的弱酸根离子(或弱碱离子)与水电离产生的H+(或OH-)结合生成弱电解质的反应。
无影响 中性
促进水的电离 酸性
促进水的电离 碱性
1.判断下列盐类在水溶液中的酸碱性,并写出水解的离子方程式。 FeCl3、NaClO、NH4NO3、Na2CO3、(NH4)2SO4
2. 实验测得NaHCO3溶液pH>7,请从电离和水解两方面分析其中的原因。
1.盐类水解的实质是什么?
在溶液中盐电离出来的弱碱的阳离子或弱酸的阴离子结合水电离出的OH-或H+生成弱电解质,破坏了水的电离平衡,促进了水的电离,使溶液显示不同的酸性、碱性或中性。
2.盐类水解有哪些特点?
①与酸碱中和反应互为可逆反应,是吸热反应。②一般情况下,盐类水解程度极其微弱。③符合化学平衡移动的原理。
请列举常见的弱酸根离子和弱碱离子
常见的弱酸根离子:CO32-、HCO3-、SO32-、CH3COO-、AlO2-、S2-、HS-、F-、ClO-、其他有机酸根离子等。常见的弱碱离子:NH4+、Al3+、Fe2+、Fe3+、Cu2+、Ag+等。
1.下列关于盐溶液呈酸碱性的说法错误的是( )A.盐溶液呈酸碱性的原因是破坏了水的电离平衡B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)C.在CH3COONa溶液中,由水电离的c(OH-)≠c(H+)D.水电离出的H+和OH-与盐中弱离子结合,造成盐溶液呈酸碱性
2.在水中加入下列物质,可使水的电离平衡正向移动,且所得溶液呈酸性的是( )A.NaCl B.H2SO4C.Na2CO3 D.NH4Cl
答案:D解析:A项,NaCl对水的电离平衡无影响,溶液呈中性;B项,H2SO4中H+抑制水电离,且溶液呈酸性;C项,Na2CO3水解促进水电离,溶液呈碱性;D项,NH4Cl水解促进水电离,溶液呈酸性。
高中化学人教版 (2019)选择性必修1第三节 盐类的水解获奖ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解获奖ppt课件,共33页。PPT课件主要包含了盐类的酸碱性,③④⑦⑧,①⑤⑥⑩,纯水中,NH3·H2O,CH3COOH,盐类的水解,弱酸阴离子,弱碱阳离子,OH-等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三节 盐类的水解精品ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解精品ppt课件,共40页。PPT课件主要包含了知识梳理,正误判断,问题导学,核心突破,试题调研,课后作业等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解教学演示ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解教学演示ppt课件,共16页。PPT课件主要包含了学习目标,实验探究,课堂探究,防止氯化镁水解,交流讨论,归纳小结,课堂练习等内容,欢迎下载使用。













