





- 人教版 (新课标)选修4 化学反应原理 3.2 水的电离和溶液的酸碱性(第2课时 溶液的酸碱性与pH) 课后练习 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 3.2 水的电离和溶液的酸碱性(第2课时 溶液的酸碱性与pH) 课件 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 3.3 盐类的水解(第1课时 盐溶液的酸碱性和盐类的水解)(课后精炼) 试卷 0 次下载
- 人教版 (新课标)选修4 化学反应原理 3.3 盐类的水解(第2课时 盐类的水解的影响因素和应用) 课后练习 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 3.3+盐类的水解(第2课时+盐类的水解的影响因素和应用) 课件 课件 0 次下载
人教版 (新课标)选修4 化学反应原理第三节 盐类的水解公开课课件ppt
展开第三节 盐类的水解(第1课时 盐溶液的酸碱性和盐类的水解)
第三章 水溶液中的离子平衡
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
【小试牛刀】将下列8种盐按生成盐的酸、碱的强弱进行分类,CH3COONa、NaCl、FeCl3、K2SO4、(NH4)2SO4、Na2CO3、(NH4)2CO3、CH3COONH4,填入下列空白处。
强酸强碱盐:_______________。
强酸弱碱盐:____________________。
FeCl3、 (NH4)2SO4
强碱弱酸盐:____________________。
Na2CO3、CH3COONa
弱酸弱碱盐:_______________________。
(NH4)2CO3、CH3COONH4
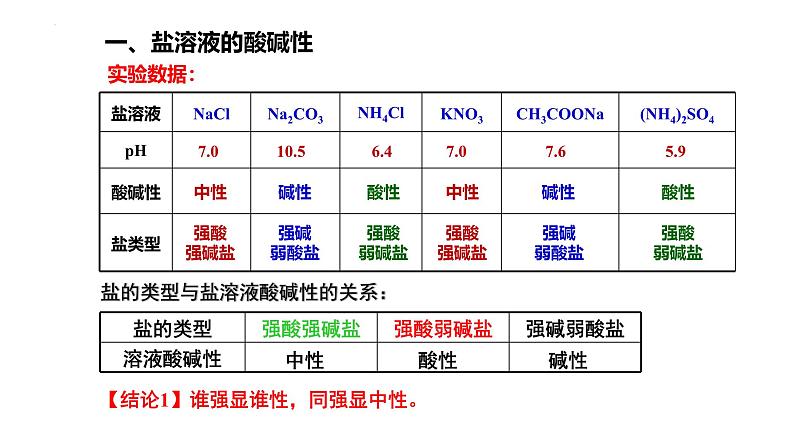
(1)选择合适的方法测试表格所列盐溶液的酸碱性。
【实验探究】测定NaCl、Na2CO3、NH4Cl、KNO3、CH3COONa、(NH4)2SO4溶液的酸碱性。
酸溶液呈酸性,碱溶液呈碱性,那么盐溶液的酸碱性如何呢?
认真观察实验,记录实验数据,填入下列表格
7.0 10.5 6.4 7.0 7.6 5.9
盐的类型与盐溶液酸碱性的关系:
【结论1】谁强显谁性,同强显中性。
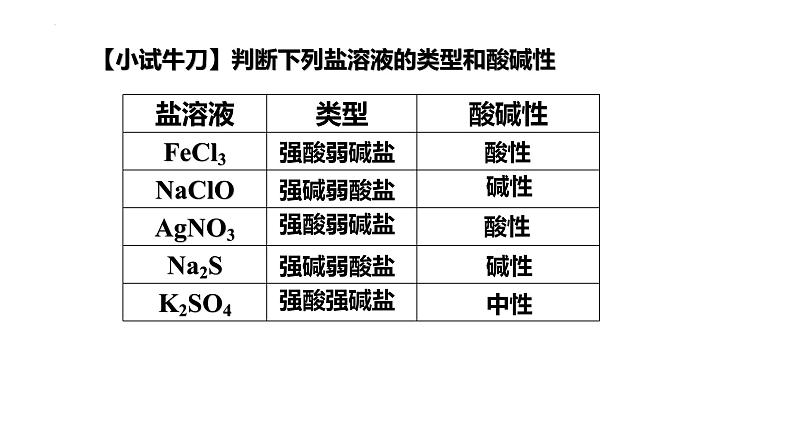
【小试牛刀】判断下列盐溶液的类型和酸碱性
盐溶液为什么会出现不同的酸碱性?
分小组讨论并完成下表。
NH4Cl=Cl– +NH4+
c(H+)>c(OH–)
NH4Cl = NH4+ + Cl-
CH3COONa=Na+ +CH3COO–
c(H+)<c(OH–)
CH3COONa= CH3COO– + Na+
CH3COONa+H2O CH3COOH+NaOH
CH3COO–+H2O CH3COOH+OH–
c(H+)=c(OH–)
【结论2】有弱才水解,无弱不水解。
NaCl=Cl– +Na+
【小试牛刀】下列关于盐溶液呈酸碱性的说法错误的是( ) A.盐溶液呈酸碱性的原因是破坏了水的电离平衡 B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-) C.在CH3COONa溶液中,由水电离的c(OH-)≠c(H+) D.水电离出的H+和OH-与盐中弱离子结合,造成盐溶液呈酸碱性
【再来一刀】NH4Cl溶于重水(D2O)后,产生的一水合氨和水合氢离子均正确的是( ) A.NH2D·H2O和D3O+ B.NH3·D2O和HD2O+ C.NH3·HDO和D3O+ D.NH2D·HDO和H2DO+
盐电离产生的弱酸根或弱碱根与水电离产生的H+或OH-结合生成弱酸或弱碱
促进水的电离,使 c(H+) ≠ c(OH–),从而表现出不同的酸碱性。
已知常温下,0.1ml/L的CH3COONa水解度大约0.024%。
三、盐类水解方程式的书写(离子方程式)
2.不标“↓”或“↑”
3.多元弱酸根水解分步书写,以第一步为主
4.多元弱碱根,一步写完
【小试牛刀】书写下列盐溶液的水解方程式
2.向三份0.1 ml/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为( ) A.减小、增大、减小 B.增大、减小、减小 C.减小、增大、增大 D.增大、减小、增大
1.在25℃时,浓度均为0.5 ml/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的三种溶液,测得各溶液的c(NH4+)分别为a、b、c(单位为ml/L),下列判断正确的是( ) A.a=b=c B.a>b>cC.a>c>bD.c>a>b
3.下列关于电解质溶液中离子关系的说法中正确的是( ) A.0.1ml·L-1Na2CO3溶液中离子浓度关系: c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) B.0.1ml·L-1NH4Cl和0.1ml·L-1NH3·H2O等体积混合后离子浓度关系c(Cl-)>c(NH4+)>c(H+)>c(OH-) C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合液溶中:c(Na+)=c(CH3COO-) D.常温下,在pH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存
4.25 ℃时,用pH试纸测得0.1 ml·L-1 NaNO2溶液的pH>7。 (1)NaNO2溶液pH>7的原因是(用离子方程式表示)______________________________,NaNO2溶液中c(HNO2)=________________(用溶液中其他离子的浓度关系式表示)。 (2)常温下,将0.2 ml·L-1的HNO2和0.1 ml·L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明HNO2的电离程度_____(填“大于”或“小于”)NaNO2的水解程度。该混合溶液中离子浓度由大到小的顺序是__________________________________。 (3)常温下,pH=3的HNO2溶液和pH=11的NaOH溶液等体积混合后溶液pH____(填“大于”或“小于”,下同)7,c(Na+)___c(NO2-)。
c(OH-)-c(H+)
c(NO2-)>c(Na+)>c(H+)>c(OH-)
人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解优秀ppt课件: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002428_t3/?tag_id=26" target="_blank">第三章 水溶液中的离子反应与平衡第三节 盐类的水解优秀ppt课件</a>,文件包含33盐类的水解第1课时盐类的水解pptx、media1mp4等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
化学选择性必修1第三节 盐类的水解一等奖ppt课件: 这是一份化学选择性必修1第三节 盐类的水解一等奖ppt课件,共28页。PPT课件主要包含了你知道吗,知识回顾,活动与探究,盐溶液的酸碱性,盐类的水解,如AlCl3,②完全双水解等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第三章 水溶液中的离子平衡第三节 盐类的水解教案配套ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三章 水溶液中的离子平衡第三节 盐类的水解教案配套ppt课件,共33页。PPT课件主要包含了探究一,探究二,探究三等内容,欢迎下载使用。













