





人教版 (新课标)选修4 化学反应原理第三节 盐类的水解课堂教学课件ppt
展开水呈中性,是因为水中的H+的浓度与OH-的浓度相等;酸呈酸性,是因为酸能够电离出H+而使溶液中的H+的浓度大于OH-的浓度;碱呈碱性,则是由于碱能够电离出OH-而使溶液中的OH-的浓度大于H+的浓度的缘故。
思考:那盐溶液的酸碱性如何呢,是否一定是呈中性呢?
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
酸 + 碱 == 盐 + 水 (中和反应)
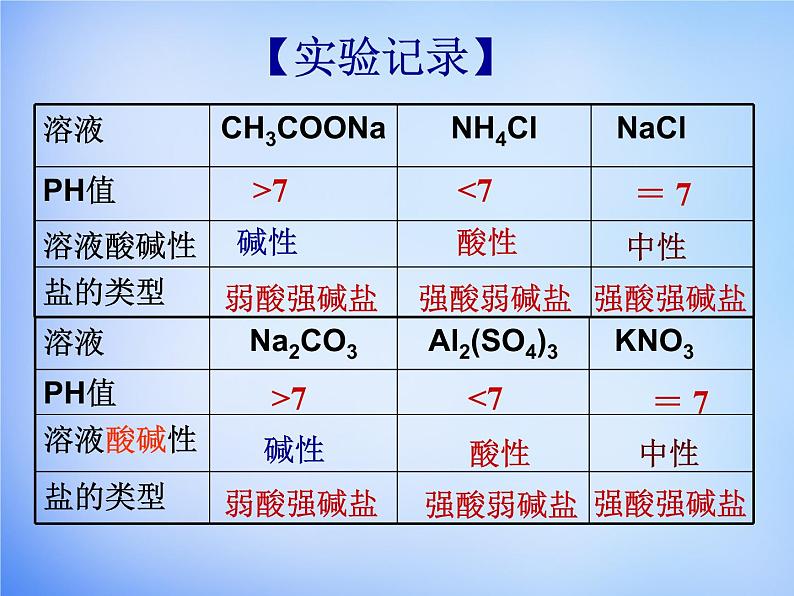
NaCl、 K2SO4
FeCl3、NH4Cl
CH3COONH4、(NH4)2CO3
CH3COONa、K2CO3
思考:我们常用什么方法来确定溶液的酸碱性呢?
Ⅰ:用PH试纸分别测定CH3COONa、NH4Cl、 NaCl、Al2(SO4)3、 KNO3溶液的酸碱性。
Ⅱ:取1 - 2ml 0.1ml/L的Na2CO3溶液于试管中,向试管中滴入酚酞试液,观察溶液颜色是否变化?
一、探究盐溶液的酸碱性的规律
谁强显谁性,同强显中性!
即:强酸弱碱盐呈酸性 弱酸强碱盐呈碱性 强酸强碱盐呈中性
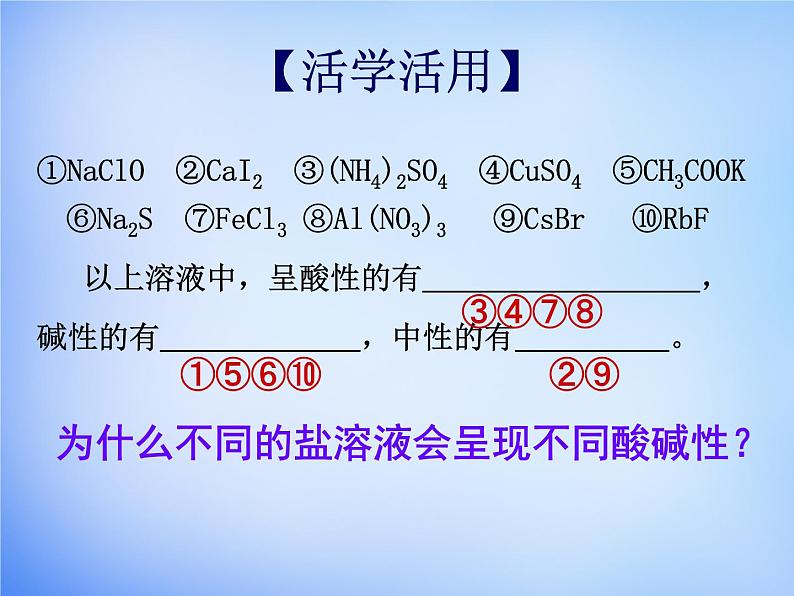
①NaClO ②CaI2 ③(NH4)2SO4 ④CuSO4 ⑤CH3COOK ⑥Na2S ⑦FeCl3 ⑧Al(NO3)3 ⑨CsBr ⑩RbF 以上溶液中,呈酸性的有 ,碱性的有 ,中性的有 。
为什么不同的盐溶液会呈现不同酸碱性?
Na2CO3、CH3COONa溶液为什么显碱性?
CH3COONa = CH3COO_ +Na+
所以: C(OH-) > C(H+) ,溶液呈碱性
二、盐溶液呈现不同酸碱性的原因
Na2CO3 = CO32_ + Na+
NH4Cl溶液为什么显酸性?
C(H+) >C(OH-)
那为什么NaCl溶液呈现中性呢?
Na+与Cl-均不能结合水中电离出来的H+或OH-,水的电离不发生移动,溶液中c(H+) = c(OH-),显中性。
1、定义:在盐溶液中,盐电离出的离子跟水所电离出的H+或OH-结合生成弱电解质的反应就叫做盐类的水解。
弱酸阴离子或弱碱阳离子
盐 + 水 酸 + 碱
使 c (H+) ≠ c (OH–)
一般不用“↑”或“↓”;一般不写“ ”,而写 “ ”。
⑸ 多元弱酸根离子分步水解,以第一步水解为主。
比较Na2CO3和CH3COONa的碱性?
碳酸比醋酸的酸性弱,CO32-越容易结合水电里出来的H+,水解程度:CO32->CH3COO2-
⑴ 有__才水解;无__不水解;⑵ 越__越水解;谁__谁水解;⑶ 谁__显谁性;同强显__性。
在溶液中,不能发生水解的离子是( ) A、ClO - B、CO32- C、Fe3+ D、SO42--
等浓度的下列物质的溶液中:①BaCl2 ②Na2CO3③NH4Cl ④CH3COONa ,其PH值由大到小的顺序是 。
CH3COONa溶液中有哪些离子?其浓度大小顺序呢?
C(Na+) >C(CH3C00-) >C(OH-) >C(H+)
1、盐类水解的定义2、盐类水解的条件3、盐类水解的实质4、盐类水解的特点5、盐类水解的规律
⒈掌握盐类水解方程式及离子方程式的书写⒉理解影响盐类水解的因素 3.判断离子浓度大小 4、盐类水解的应用
1、水解离子方程式的书写2、判断离子浓度的大小
判断离子浓度的大小及“四守恒”
盐溶于水电离出的“弱离子”与水电离出的H+或者OH-相结合生成弱电解质,而使溶液呈碱性或者酸性
⑴ 有弱才水解;无弱不水解;⑵ 越弱越水解;谁弱谁水解;⑶ 谁强显谁性;同强显中性。
3.下列盐的水溶液中:① FeCl3 ② NaClO ③ (NH4)2SO4 ④ AgNO3 ⑤ Na2S ⑥ K2SO4。 哪些呈酸性( ) 哪些呈碱性( )
思考:它们水解的方程式怎么写呢?
四、盐类水解方程式的书写:
如,NH4Cl溶液的水解
请分别写出CH3COONa和NaClO水解的化学方程式和离子方程式:
3、多元弱酸盐分步水解,但以第一步水解为主。
如,Na2CO3溶液的水解离子方程式为:
请分别写出Na2SO3和Na2S水解的离子方程式
4、多元弱碱盐的水解,常一步书写完成。
如,AlCl3溶液的水解离子方程式为:
请分别写出CuSO4和FeCl3水解的离子方程式
5、多元弱酸酸式酸根的水解与电离的区别:
如, NaHSO3溶液:
∴溶液呈 性
除NaHSO3和NaH2PO4以电离程度大于水解程度呈酸性外,其余多元弱酸的酸式盐电离程度均小于其水解程度而使溶液呈碱性
6、对于发生“完全双水解”的盐类,因水解彻底,故用“=”,同时有沉淀↓和气体↑产生。
常见完全双水解的离子——Al3+与AlO2-、HCO3-、CO32-、S2-、HS-、ClO-Fe3+与AlO2-、HCO3-、CO32-NH4+与SiO32-
如:①AlCl3溶液与NaAlO2溶液反应离子方程式为:
Al3++3AlO2-+6H2O=4Al(OH)3↓
②AlCl3溶液与NaHCO3溶液反应离子方程式为:
Al3++3HCO3-=Al(OH)3↓+3CO2↑
五、盐类水解平衡影响因素
在一定条件下,当盐类的水解生成酸和碱的速率和酸和碱发生中和反应的速率相等时,达到水解平衡。
NaClO (aq) CH3COONa (aq)
HClO CH3COOH
Na2CO3 (aq) NaHCO3 (aq)
HCO3– H2CO3
∴ 正盐的水解程度 酸式盐的水解程度
MgCl2 (aq) AlCl3 (aq)
Mg(OH)2 Al(OH)3
弱碱阳离子的水解。
弱酸根离子的水解。
配制FeCl3溶液需要注意什么问题?
加入一定量的 ,抑制FeCl3的水解。
CH3COO– + H2O CH3COOH + OH–
25℃时,在浓度为1 ml·L-1的(NH4)2SO4、(NH4)2 CO3、(NH4)2Fe(SO4)2的溶液中,测得c(NH4+)分别为a、b、c(单位为ml·L-1)。下列判断正确的是( ) A.a=b=c B.a>b>c C.a>c>b D.c>a>b
1.为什么KAl(SO4)2(明矾) , FeCl3 等盐可用做净水剂?
4.在必修I学习胶体性质时,我们知道制取氢氧化铁胶体时是在沸水中滴入FeCl3溶液,你现在知道其中的原理了吗?
2.纯碱为什么能去污力?去污是为何用热水?
3.泡沫灭火器的化学反应原理是什么?
塑料内筒装有Al2(SO4)3溶液
外筒装有NaHCO3溶液
Al2(SO4)3 和 NaHCO3溶液:
Al 3+ + 3HCO3– Al(OH)3 + 3CO2
(一)日常生活中的应用
盐作净化剂的原理:明矾、FeCl3 等
本身无毒,胶体可吸附不溶性杂质,起到净水作用。
热的纯碱去污能力更强,为什么?
升温,促进CO32–水解。
(二) 易水解盐溶液的配制与保存:
配制 FeCl3溶液:加少量 ;
配制 FeCl2溶液:加少量 ;
配制 FeSO4溶液:加少量 ;
(三) 判断盐溶液的酸碱性:
CH3COONH4溶液
(四) 判定离子能否大量共存:
Al3+ 与 AlO2–
Al3+ 与 HCO3–
Al3+ 与 CO32–
(五) 某些盐的无水物,不能用蒸发溶液的方法制取
MgCl2· 6H2O
晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2
FeCl3 溶液 ,Na2SO3 溶液 ,Fe(NO3)3 溶液 ,Ca(HCO3)2 溶液 ,Fe2(SO4)3 溶液 .
下列盐溶液加热蒸干、灼烧后,得到什么固体物质?
(六)水溶液中微粒浓度的大小比较:
② 多元弱酸电离是分步,主要决定第一步
① 弱电解质电离是微弱的
如: NH3 · H2O 溶液中:c (NH3 · H2O) c (OH–) c (NH4+) c (H+)
如:H2S溶液中:c (H2S) c (H+) c (HS–) c (S2–) c (OH–)
对于弱酸、弱碱,其电离程度小,产生的离子浓度远远小于弱电解质分子的浓度。
① 弱离子由于水解而损耗。
如:KAl(SO4)2 溶液中:c (K+) c (Al3+)
③ 多元弱酸水解是分步,主要决定第一步
c (Cl–) c (NH4+) c (H+) c (NH3·H2O) c (OH–)
如:Na2CO3 溶液中:c (CO3–) c (OH–) c (HCO3–) c (H2CO3)
单水解程度很小,水解产生的离子或分子浓度远远小于弱离子的浓度。
如:NH4Cl 溶液中:
(六)、水溶液中微粒浓度的大小比较:
如:NH4Cl 溶液中 阳离子: NH4+ H+ 阴离子: Cl– OH– 正电荷总数 == 负电荷总数n ( NH4+ ) + n ( H+ ) == n ( Cl– ) + n ( OH– )
溶液中阴离子和阳离子所带的电荷总数相等。
c ( NH4+ ) + c ( H+ ) == c ( Cl– ) + c ( OH– )
七、电解质溶液中的守恒关系
七、电解质溶液中的守恒关系
阳离子: 阴离子:
又如:Na2S 溶液 Na2S == 2Na+ + S2– H2O H+ + OH– S2– + H2O HS– + OH– HS– + H2O H2S + OH–
c (Na+ ) + c ( H+ ) == c ( OH– ) + 2c ( S2–) + c ( HS– )
∵ 正电荷总数 == 负电荷总数
OH– 、S2– 、HS–
Na2CO3 溶液中有哪些离子?其电荷守恒关系式为
c (Na+ ) + c ( H+ ) == c ( OH– ) + 2c (CO3 2–) + c ( HCO3– )
是指某一元素的原始浓度应该等于该元素在溶液中各种存在形式的浓度之和。
∴ c (Na+ ) = 2 [c (CO32–) + c (HCO3–) + c (H2CO3) ]
c (Na+ ) = 2 a ml / L
c (CO32–) + c (HCO3–) + c (H2CO3) = a ml / L
即 c (Na+) : c (C) =2 : 1
Na2S 溶液中物料守恒关系式为:
因此:c (Na+ ) == 2 [ c ( S2–) + c (HS–) + c (H2S) ]
c (Na+) : c (S) =2 : 1
结合学过的知识分析NaHCO3溶液中微粒里浓度间的关系
c (Na+)=c (HCO3–) + c (CO32–) + c (H2CO3)
①根据HCO3–水解大于电离程度判断
②根据阴阳离子电荷守恒判断
c (Na+ ) + c ( H+ ) = c ( OH– ) + 2c (CO3 2–) + c ( HCO3– )
电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。或者理解为:c(H+)H2O =c(OH-)H2O
为得到质子后的产物, 为失去质子后的产物,
NH3·H2O、OH–、
所以:c(H+) = c(NH3·H2O) + c(OH–)
c(OH-)H2O= c(NH3·H2O) + c(OH–)
试分析CH3COONa溶液和Na2CO3溶液中质子守恒关系
c(H+) + c(CH3COOH) = c(OH–)
CH3COONa溶液中:
c ( OH- ) = c (H+ ) + 2c (H2CO3 ) + c ( HCO3– )
人教版 (新课标)选修4 化学反应原理第三节 盐类的水解备课课件ppt: 这是一份人教版 (新课标)选修4 化学反应原理第三节 盐类的水解备课课件ppt,共23页。PPT课件主要包含了盐类水解平衡影响因素,HCl,课堂练习一,盐类水解的应用,合作探究,课堂练习三,课堂练习四,课堂练习五,电离方程式,水解方程式等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第三节 盐类的水解授课ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 盐类的水解授课ppt课件,共52页。PPT课件主要包含了①③④,课堂练习,解题指导,例题分析等内容,欢迎下载使用。
高中人教版 (新课标)第三节 盐类的水解教课内容课件ppt: 这是一份高中人教版 (新课标)第三节 盐类的水解教课内容课件ppt,共33页。PPT课件主要包含了思考与交流,C时成立,盐溶液不一定显中性,探究主题,盐溶液的酸碱性,讨论·分析,盐类水解的定义,温故而知新,课堂练习,结论“越弱越水解”等内容,欢迎下载使用。













