



人教版 (2019)必修 第一册第三节 氧化还原反应优秀课件ppt
展开1.通过典例分析、归纳小结,从宏观和微观相结合的角度认识和判断氧化剂、还原剂,熟悉氧化还原反应中各概念间的关系。 2.通过阅读归纳、练习应用,依据氧化还原反应原理,预测物质的化学性质和变化,知道常见的氧化剂和还原剂。 3.通过讨论交流、问题探究,学会用单、双线桥法分析氧化还原反应电子转移的方向和数目,初步感受化学反应中的“电子守恒”思想。理解物质的氧化性、还原性,并初步建立判断物质氧化性、还原性强弱的思维模型。
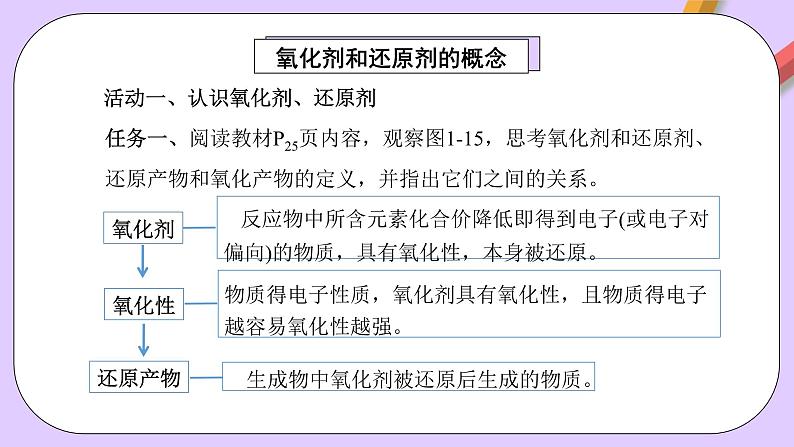
活动一、认识氧化剂、还原剂
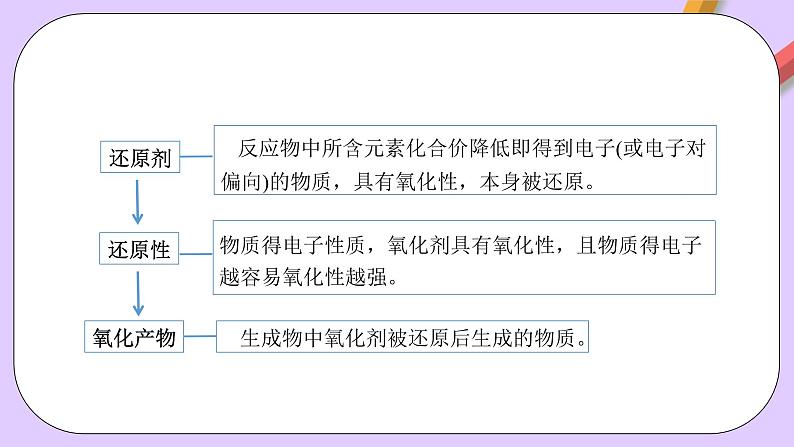
任务一、阅读教材P25页内容,观察图1-15,思考氧化剂和还原剂、还原产物和氧化产物的定义,并指出它们之间的关系。
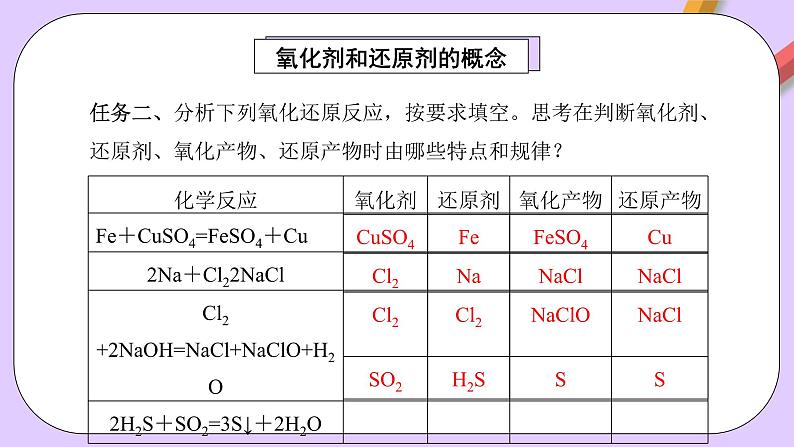
任务二、分析下列氧化还原反应,按要求填空。思考在判断氧化剂、还原剂、氧化产物、还原产物时由哪些特点和规律?
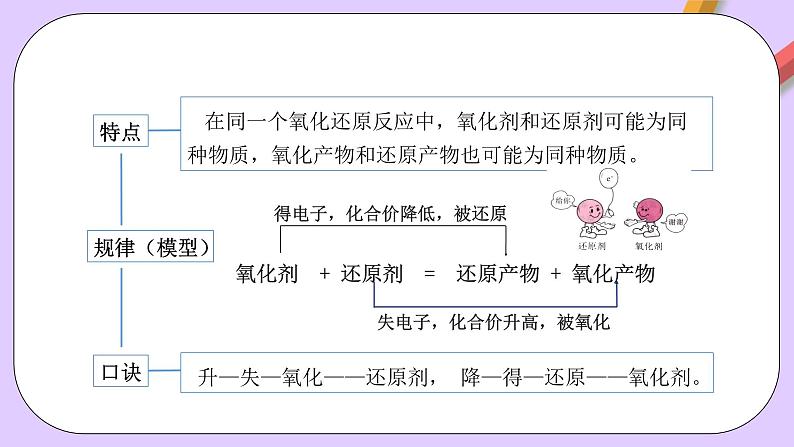
氧化剂 + 还原剂 = 还原产物 + 氧化产物
得电子,化合价降低,被还原
失电子,化合价升高,被氧化
【典例1】下列说法正确的是( ) A.在氧化还原反应中,氧化剂经化学变化变成还原剂 B.在氧化还原反应中,氧化剂被氧化,还原剂被还原 C.在化学反应中,能把其他物质氧化的物质是氧化剂 D.在氧化还原反应中,还原剂生成的氧化产物一定只具有氧化性
【解析】氧化剂、还原剂都是反应物,氧化剂经化学变化变成还原产物,A项错误;氧化剂得电子被还原,还原剂失电子被氧化,B项错误;氧化剂能把其他物质氧化,还原剂能把其他物质还原,C项正确;还原剂、还原产物都具有还原性,氧化剂、氧化产物都具有氧化性,但氧化产物也可能具有还原性,D项错误。
【典例2】在下列反应中,水仅作还原剂的是( )A.Na2O+H2O===2NaOH B.2F2+2H2O===4HF+O2 C.Cl2+H2O===HCl+HClO D.2K+2H2O===2KOH+H2↑
【解析】A项,在反应Na2O+H2O===2NaOH中,各元素的化合价均不变化,不是氧化还原反应,错误;B项,在反应2F2+2H2O===4HF+O2中,F元素从0价降低到-1价,单质氟是氧化剂。水中氧元素从-2价升高到0价,水是还原剂,正确;C项,在反应Cl2+H2O===HCl+HClO中,氯元素的化合价既升高,也降低,因此氯气既是氧化剂,也是还原剂,错误;D项,在反应2K+2H2O===2KOH+H2↑中,K元素从0价升高到+1价,K是还原剂。水中的氢元素从+1价降低到0价,水是氧化剂,错误。
活动二、常见氧化剂和还原剂
任务一、讨论交流:元素的化合价与得失电子、氧化性、还原性有什么关系?
只能失去电子,表现出还原性。
只能得到电子,表现出氧化性。
既能得到电子,又能失去电子,表现出氧化性,既表现出氧化性,又表现出还原性。
金属单质只能失电子,表现出还原性,非金属单质则既可失电子,表现出还原性,又可得电子,表现出氧化性。
任务二、元素由游离态转变为化合态是否一定被氧化?非金属单质在氧化还原反应中作反应物时一定是氧化剂吗?
不一定。元素由游离态转变为化合态既可能被氧化,又可能被还原,还可能既被氧化又被还原;如:S+2H2SO4(浓)==3SO2↑+2H2O(S被氧化),Cl2+2KBr ==2KCl+Br2(Cl被还原),Cl2+H2O==HCl+HClO(Cl既被氧化,又被还原)。不一定。非金属单质在氧化还原反应中,可能作氧化剂如Cl2、O2,也可能作还原剂,如C、H2。还可能既作氧化剂又做还原剂如S、Cl2等
任务三、根据氧化性和还原性的定义,结合所学知识,列出你所知道的常见氧化剂和还原剂。
①常见的氧化剂:活泼性较强的非金属单质:如Cl2、O2;变价元素的高价态化合物:如KMnO4、FeCl3、HNO3;过氧化物:如Na2O2、H2O2;其他:如HClO、漂白粉、MnO2等。 ②常见的还原剂:活泼性较强的金属单质:如Al、Fe、Zn;某些非金属单质:如H2、S、C;含有较低价态元素的化合物:如CO、SO2;其他:如浓盐酸、NH3等。 ③注意:Fe2+、SO32-主要表现还原性,H2O2主要表现氧化性。
【典例1】下列物质中的氮元素只能体现氧化性的是( ) A.NH3 B.NO C.NO2 D.HNO3
【解析】氨气中氮元素处于最低价,该物质只有还原性,不能表现氧化性,故A错误;NO中氮元素的化合价处于中间价,既有氧化性又有还原性,故B错误;NO2中氮元素的化合价处于中间价,既有氧化性又有还原性,故C错误;HNO3氮元素处于最高价,该物质中的硫元素只能表现氧化性,故D正确。
【典例2】亚硫酸钠(Na2SO3)在反应中既可作氧化剂,又可作还原剂。当它作氧化剂时,理论上可能被还原成的是( ) ①H2SO4 ②S ③Na2S ④Na2SO4 ⑤H2SO3 ⑥Na2S2O3 A.①④ B.①②③ C.①⑤⑥ D.②③⑥
【解析】Na2SO3中S元素的化合价为+4价,当它作氧化剂时,S元素的化合价将降低,而②③⑥中硫元素的化合价均低于+6。
活动三、预测并实验探究物质的氧化性或还原性
任务一、讨论交流:结合离子的检验方法,思考如何预测并设计实验验证物质的氧化性和还原性?
探究物质氧化性和还原性
物质的组成和结构,分析元素化合价,预测氧化性或还原性。如FeCl2溶液具有还原性,FeCl3溶液具有氧化性等。
氧化性物质→加入还原剂→特殊现象→得出结论; 还原性物质→加入氧化剂→特殊现象→得出结论。
任务二、应用探究:已知H2O2(无色,具有氧化性,能氧化Fe2+),FeCl2溶液显浅绿色,FeCl3溶液显黄色,FeCl3溶液遇KSCN溶液显血宏色。请利用提供的试剂,设计合理、有效的实验方案,完成以下探究实验。
试剂:铁粉、稀硫酸、FeCl2溶液、FeCl3溶液、氯水、KSCN溶液、 维生素C(具有还原性)
实验1:预测Fe2+具有还原性并探究:
FeCl2溶液、H2O2、KSCN溶液
FeCl2溶液+H2O2→溶液由浅绿色变成黄色+KSCN溶液→溶液出现血红色
实验2:预测Fe3+具有氧化性并探究:
FeCl3溶液、维生素C、KSCN溶液
FeCl3溶液+足量维生素C→溶液由黄色变浅绿成色+KSCN溶液→溶液不出现血红色
【典例1】根据下列实验操作和现象所得到的结论正确的是( )
【典例2】碘缺乏病是机体因缺碘导致的疾病,即地方性甲状腺肿大和 地方性克汀病,主要病因是环境缺碘,人体摄取碘不足所致。 我国政府对碘缺乏病相当重视,为了消除碘缺乏病,规定在食盐中必 须加入适量的碘酸钾。检验食盐中是否加碘,可用如下反应: KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O。 (1)上述反应,氧化剂、还原剂、氧化产物、还原产物分别是什么物质? (2)上述反应中,氧化产物与还原产物的质量比是多少? (3)请分别用双线桥法和单线桥法标出该反应电子转移的方向和数目。
【答案】(1)氧化剂是KIO3,还原剂是KI,氧化产物、还原产物均是I2。
活动一、用双线桥法分析氧化还原反应
任务一、观察教材P23⁓24页钠与氯气、钠与氢气反应时,电子转移分析图 示,思考其特点和书写步骤是什么?并回答什么是双线桥法?
表明同一元素原子得到或失去电子的情况。
①标价态:反应前后同一元素的化合价变化。②连双线:氧化剂→还原产物(同元素)、还原剂→氧化产物(同元素)。 ③写项目:标出“失去”或“得到”电子的总数(必写)、“被氧化”或“被还原”(根据要求写)。
任务二、在用双线桥法表示电子转移情况时,箭头的指向能表示电子转移的方向吗?两个线桥上表示的电子总数有何关系?并结合反应8NH3 + 6NO2 = 7N2 + 12H2O,回答:氧化剂、还原剂、氧化产物、还原产物分别是什么物质?并用双线桥法标出电子转移的情况。
【分析】①箭头方向不代表电子转移方向,仅表示电子转移前后的变化, 双线桥不能表示电子转移方向;只能表明同一元素原子的电子转移情况。
8NH3 + 6NO2 === 7N2 + 12H2O
-3 +4 0
失8×3e-,被氧化,发生氧化反应
得6×4e-,被还原,发生还原反应
【典例1】下列标明电子转移的方向和数目的化学方程式中正确的是( )
【解析】A项,锌原子失去电子,氢原子得到电子,错误;B项,氯酸钾中氯元素由+5价降低到0价,得到5个电子,盐酸中氯元素由-1价升高到0价,失去5个电子,正确;C项,2个铁原子失去6个电子,3个氯气分子得到6个电子,错误;D项,1个铜原子失去2个电子,硝酸得到2个电子,错误。
【典例2】硫单质在反应3S+6KOH===2K2S+K2SO3+3H2O中的变化是( ) A.被氧化 B.被还原 C.既被氧化又被还原 D.既未被氧化又未被还原
【解析】该反应中单质硫中的硫元素化合价为0价,一部分升高到+4价,一部分降低到一2价,故在反应中硫单质既被氧化又被还原。
活动二、用单线桥法分析氧化还原反应
任务一、阅读教材P25两个反应表达式,分析两式的特点,思考如何用单线桥法的表示电子转移的方向和数目?
表示反应前后不同元素原子间电子转移情况。
①标价态:反应前后同一元素的价态变化。②连单线:等式左边的剂还原→氧化剂。 ③写数目:标出转移的电子总数。
任务二、在用单线桥法表示电子转移情况时,箭头指向的含义是什么?结合反应2KMnO4+16HCl(浓)==2KCl+2MnCl2+5Cl2↑+8H2O进行分析,指出被还原和被氧化的元素分别是什么?并用单线桥法表示该反应中电子转移情况。
【分析】①单线桥法箭头指向为氧化剂和还原剂之间转移电子的方向。
② 2KMnO4+16HCl(浓)==2KCl+2MnCl2+5Cl2↑+8H2O
+7 -1 +2 0
得或失电子总数,但不标“得”或“失”
【典例1】下列化学反应中用单线桥表示电子转移的方法正确的是( ) A. B. C. D.
【解析】A项,1个Fe原子失去2个电子,盐酸中的H+得到2个电子,生成1个H2分子,A项正确;B项,Cu失电子,H2SO4中的硫元素得到电子,箭号方向应该由Cu指向S,B项错误;C项,2个Na共失去2个电子,C项错误;D项,转移电子总数为10,且KI中I-失电子,KMnO4中Mn元素得到电子,箭号方向应该由I指向Mn,D项错误。故选A。
【典例2】已知铜在常温下能被浓硝酸溶解,其反应的化学方程式为 Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O。用单线桥法表示电子得 失的方向和数目,若3 个 Cu参加反应,则该过程转移的电子是多少?
【答案】①单线桥法表示电子得失的方向和数目:
【解析】①该反应中Cu的化合价变化是0价→+2价,1 个 Cu失去2 个电子;HNO3中氮元素部分化合价由+5价→+4价,生成1个 NO2,转移1 个电子。②1 ml Cu失去2 ml电子,故3 ml Cu失去6 ml电子。
1.下列关于氧化还原反应的叙述,正确的是( ) A.失去电子的反应是还原反应 B.作氧化剂的物质不能是还原剂 C.发生氧化反应的物质是氧化剂D.失去电子的物质是还原剂
【解析】A.失去电子的物质是还原剂,发生氧化反应,故A错误;B.作氧化剂的物质也可能是还原剂,例如反应Cl2+2NaOH=NaCl+NaClO+H2O中,氯气既是氧化剂又是还原剂,故B错误;C.得电子的物质是氧化剂,发生还原反应,故C错误;D.失去电子化合价升高的物质是还原剂,故D正确;答案选D。
2.下列反应中,SO2表现氧化性的是( ) A.2SO2+O2 2SO3 B.SO2+H2O=H2SO3 C.2H2S+SO2=3S↓+2H2O D.SO2+2H2O+Cl2=H2SO4+2HCl
【解析】A.SO2化合价升高,被氧化,发生氧化反应,是还原剂,具有还原性;B.化合价无变化;C.SO2化合价降低,被还原,发生还原反应,是氧化剂,具有氧化性;D.SO2化合价升高,被氧化,发生氧化反应,是还原剂,具有还原性;故选C。
3.吸进人体内的氧有2%转化为氧化性极强的活性氧,活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内的活性氧,则Na2SeO3的作用是( ) A.还原剂 B.氧化剂 C.既是氧化剂又是还原剂 D.以上均不是
【解析】活性氧具有较强的氧化性,亚硒酸钠(Na2SeO3)能消除人体内的活性氧,因此亚硒酸钠具有还原性,与活性氧反应时,亚硒酸钠作还原剂,答案选A。
4.下列表示氧化还原反应中电子转移的方向和数目正确的是( )A. B.C. D.
【解析】A项,钠和氯气反应生成氯化钠,钠失电子、氯气得电子,错误;B项,氧化铜和碳反应生成铜和二氧化碳,氧化铜中铜元素得电子生成铜,碳失电子生成二氧化碳,错误;C项,氯酸钾加热分解为氯化钾和氧气,氯元素化合价由+5降低为-1、氧元素化合价由-2升高为0,错误;D项,硫化氢和浓硫酸反应生成硫、二氧化硫、水,硫化氢中S元素化合价由-2升高为0、硫酸中S元素化合价由+6降低为+4,正确。
升—失—氧化——还原剂
降—得—还原——氧化剂。
人教版 (2019)必修 第一册第三节 氧化还原反应示范课课件ppt: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161975_t3/?tag_id=26" target="_blank">第三节 氧化还原反应示范课课件ppt</a>,共25页。PPT课件主要包含了从化合价的角度理解,失2e-,得2e-,氧化剂和还原剂,Cl-,思考与讨论,还原剂,氧化剂,四组概念的关系,被还原还原反应等内容,欢迎下载使用。
化学必修 第一册第三节 氧化还原反应教课ppt课件: 这是一份化学必修 第一册<a href="/hx/tb_c161975_t3/?tag_id=26" target="_blank">第三节 氧化还原反应教课ppt课件</a>,共24页。PPT课件主要包含了氧化剂和还原剂,双线桥与单线桥,简单氧化还原,部分氧化还原,歧化反应,归中反应,复杂氧化还原,常见的氧化剂和还原剂等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一章 物质及其变化第三节 氧化还原反应教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一章 物质及其变化第三节 氧化还原反应教学课件ppt,文件包含第1课时初步认识比热容pptx、加热水和煤油mp4、比较水沙石的比热容mp4、比较金属的比热熔冰mp4、水和煤油的吸热能力对比mp4、水和煤油的吸热能力对比swf等6份课件配套教学资源,其中PPT共23页, 欢迎下载使用。













