




高中化学人教版 (2019)必修 第一册第三节 氧化还原反应公开课ppt课件
展开1.通过讨论交流、归纳小结,学会判断物质具有氧化性、还原性以及判断氧化性和还原性强弱的一般方法。 2.通过阅读归纳、练习应用,学会利用氧化性和还原性强弱判断化学反应能否发生,能用氧化还原反应的相关知识解释生活中的一些化学现象。 3. 通过分析探究,典例剖析,初步建立用氧化还原反应中的“电子守恒”思想解决简单的氧化还原计算问题的思维模型,培养解决生产生活中的化学问题的能力。
氧化还原反应的“功”与“过”
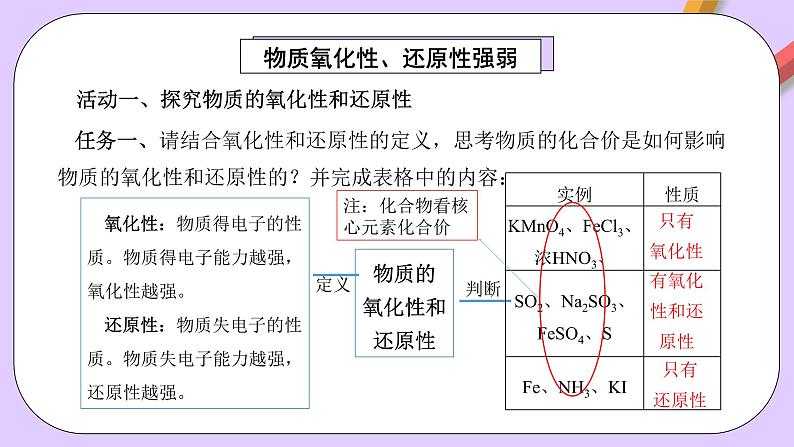
活动一、探究物质的氧化性和还原性
任务一、请结合氧化性和还原性的定义,思考物质的化合价是如何影响物质的氧化性和还原性的?并完成表格中的内容:
氧化性:物质得电子的性质。物质得电子能力越强,氧化性越强。还原性:物质失电子的性质。物质失电子能力越强,还原性越强。
注:化合物看核心元素化合价
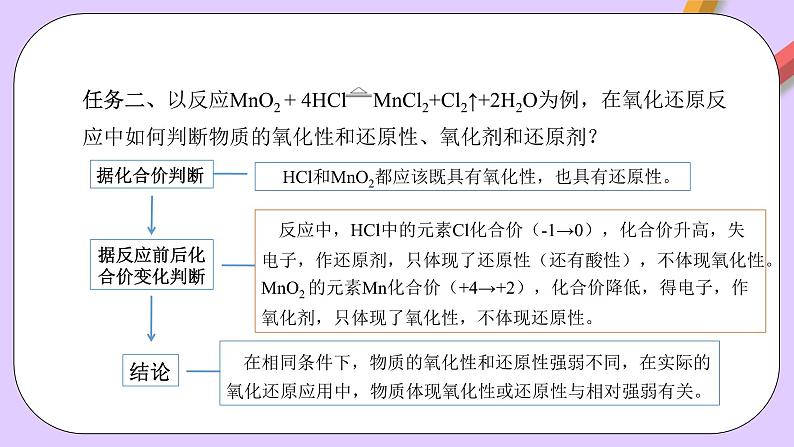
据反应前后化合价变化判断
HCl和MnO2都应该既具有氧化性,也具有还原性。
反应中,HCl中的元素Cl化合价(-1→0),化合价升高,失电子,作还原剂,只体现了还原性(还有酸性),不体现氧化性。MnO2 的元素Mn化合价(+4→+2),化合价降低,得电子,作氧化剂,只体现了氧化性,不体现还原性。
在相同条件下,物质的氧化性和还原性强弱不同,在实际的氧化还原应用中,物质体现氧化性或还原性与相对强弱有关。
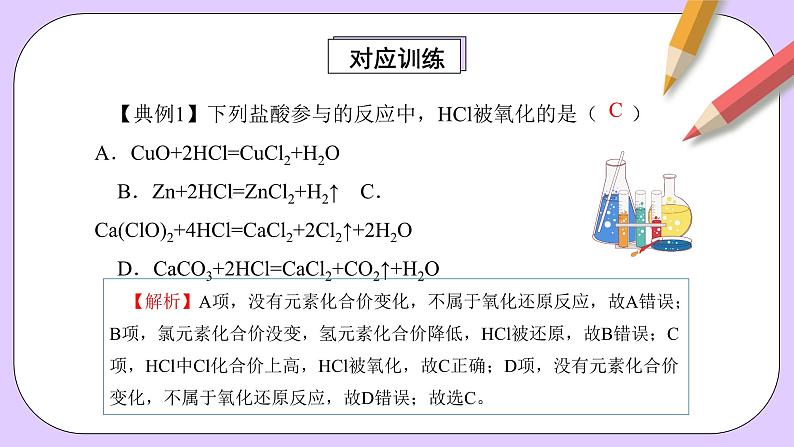
【典例1】下列盐酸参与的反应中,HCl被氧化的是( ) A.CuO+2HCl=CuCl2+H2O B.Zn+2HCl=ZnCl2+H2↑ C.Ca(ClO)2+4HCl=CaCl2+2Cl2↑+2H2O D.CaCO3+2HCl=CaCl2+CO2↑+H2O
【解析】A项,没有元素化合价变化,不属于氧化还原反应,故A错误;B项,氯元素化合价没变,氢元素化合价降低,HCl被还原,故B错误;C项,HCl中Cl化合价上高,HCl被氧化,故C正确;D项,没有元素化合价变化,不属于氧化还原反应,故D错误;故选C。
【解析】在该反应中,NaNO2为氧化剂,其中氮元素被还原;NH4Cl为还原剂,其中氮元素被氧化;氮气既是氧化产物又是还原产物,生成1分子N2时转移3个电子。
活动二、物质氧化性、还原性强弱的判断方法
氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物。特点:比什么性,找什么剂,产物之性小于剂。
越靠前,金属单质的还原性越强,越靠后,对应阳离子的氧化性越强(Fe3+的氧化性与Ag+相当)
反应越易进行或越剧烈,则氧化剂(或还原剂)的氧化性(或还原性)越强。
相同条件下,使还原剂(或氧化剂)中元素化合价升(或降)得越高(或低),则氧化剂(或还原剂)的氧化性(或还原性)越强。
任务一、讨论交流:根据所学知识,你知道判断物质氧化性、还原性强弱有哪些基本方法?并举例说明。
任务二、问题探究:金属阳离子一定只有氧化性吗?已知物质的氧化性或还原性的强弱关系,如何判断某一氧化还原反应能否发生?
①金属阳离子若处于中间价态则既有氧化性,又有还原性,如Fe2+。
②可采用假设法:第一步:假设反应成立;第二步:根据氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物的规律,列出假设反应中的上述关系;第三步:结合题干条件判断该结论是否符合事实。若符合事实,则反应能发生;反之,则反应不能发生。
任务三、拓展探究:“钠原子能失去1个电子,铝原子能失去3个电子,所以铝的还原性比钠强。”这种说法正确吗?物质氧化性或还原性的强弱与哪些因素有关?
①错误。物质氧化性、还原性的强弱与得失电子的难易程度有关,而与得失电子的多少无关。如钠失电子数小于铝,但还原性Na>Al。
②对同一元素而言,一般价态越高,氧化性越强,如Fe3+>Fe2+>Fe;价态越低,氧化性越弱,如S2-
【典例1】现有下列几个离子反应: ①Cr2O72-+14H++6Cl-===2Cr3++3Cl2↑+7H2O ②2Fe2++Br2===2Fe3++2Br- ③2Fe3++SO2+2H2O===2Fe2++SO42-+4H+ 下列有关性质的比较正确的是( ) A.氧化性:Cr2O72->Cl2>Fe3+ B.氧化性:Cl2>Br2>Cr2O72- C.还原性:SO2
【解析】根据氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,并结合卤素单质及阴离子的性质递变规律可推知,氧化性强弱顺序为Cr2O72->Cl2>Br2>Fe3+>SO42-;还原性强弱顺序为SO2>Fe2+>Br->Cl->Cr3+。
【典例2】已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是( ) A.2Fe3++SO2+2H2O===2Fe2++SO42-+4H+ B.I2+SO2+2H2O===H2SO4+2HI C.2Fe2++I2===2Fe3++2I- D.H2O2+SO2===H2SO4
【解析】A项SO2是还原剂,Fe2+是还原产物,故还原性为SO2>Fe2+,A项能发生;B项中SO2是还原剂,HI是还原产物,故还原性为SO2>I-,B项正确;C项中Fe2+是还原剂,I-是还原产物,故还原性为Fe2+>I-,与信息矛盾,故C项错;D项中SO2是还原剂,H2O2是氧化剂,故还原性为SO2>H2O2,D项正确。
活动一、探究氧化还原反应的规律
任务一、Fe2+具有较强的还原性,Fe3+具有较强的氧化性,二者之间能反应吗?请说出你知道的氧化剂和生成的还原产物、还原剂和生成的氧化产物?
①Fe2+虽可以失电子生成Fe3+,Fe3+也可以得到电子生成Fe2+或Fe,但Fe2+与Fe3+为相邻价态,无中间价态,因此二者不能反应。
②常见的氧化剂和它所生成的还原产物:
③常见的还原剂和它所生成的氧化产物:
任务二、请你说出发生氧化还原反应时,需要遵循哪些基本的规律?
还原性:还原剂>还原产物,氧化性:氧化剂>氧化产物;
同一氧化(还原)剂与多种还原(氧化)剂混合,还原(氧化)性强的先反应。
失电子总数=得电子总数=化合价降低总数=化合价升高总数。
同种元素不同价态之间发生氧化还原反应,元素的化合价“只向中间靠拢不出现交叉”,
任务三、根据上述规律思考,利用氧化还原反应的基本规律如何快速解决有关化学问题?请举例说明。
判断物质间氧化性(或还原性)强弱或判断氧化剂和有还原性物质在一定条件下是否反应。
已知①X2++Y==X+Y2+ ②Y2++W==W2++Y ③W2++Z==Z2++W三个离子反应,判断氧化性最弱的粒子。
根据反应①,氧化性:X2+>Y2+;根据反应②,氧化性:Y2+>W2+;根据反应③,氧化性:W2+>Z2+。可见,上述四种阳离子中,氧化性最弱的是Z2+。
判断物质的氧化性、还原性强弱或判断反应的先后顺序。
写出在FeBr2溶液中通入少量Cl2时的离子反应方程式。
还原性Fe2+>Br-,所以Fe2+先与Cl2反应,离子方程式为:2Fe2++2Cl2==2Fe3++2Cl-。而在FeI2溶液中通入少量Cl2,则先氧化I-。
对氧化还原反应方程式配平和进行相关计算。
Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的个数之比为1∶16,求x的值为多少?
根据化合价变化,利用“守恒”(得失电子或化合价升降)规律得关系式1×[6-(-2/x)]‧x=16×2,解得x=5。
判断氧化剂(还原剂)、氧化产物(还原产物)和判断方程式正误及有关计算等。
如:硫及其化合物的转化关系:
则⑤中不会出现H2S转化为SO2而H2SO4转化为S的情况。 ( ) ( )
【典例1】在含有Cu(NO3)2、Mg(NO3)2、AgNO3的溶液中加入适量锌粉,首先置换出的是( ) A.Mg B.Cu C.Ag D.H2
【解析】由金属活动性顺序可知,Cu2+、Mg2+、Ag+、H+的氧化性由强到弱的顺序为Ag+>Cu2+>H+>Mg2+,故混合液与锌粉反应时,首先置换出Ag。
【典例2】PbO2、KMnO4、Cl2、FeCl3、CuCl2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( ) A.Cu+2Fe3+===Cu2++2Fe2+ B.10Cl-+2MnO4-+16H+===2Mn2++5Cl2↑+8H2O C.2Fe2++Cl2===2Fe3++2Cl- D.5Pb2++2MnO4-+2H2O===5PbO2+2Mn2++4H+
【解析】氧化性:PbO2>KMnO4>Cl2>FeCl3>CuCl2,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性。A项中氧化性Fe3+>Cu2+,与条件相符;B项中,氧化性MnO4->Cl2,与条件相符;C项中,氧化性Cl2>Fe3+,与条件相符;D项中,氧化性MnO4->PbO2,与条件不相符,所以D项反应不可能发生。
利用电子守恒规律,得失电子总数相等,Na2SO3作还原剂,氧化产物为Na2SO4,其中,硫元素由+4价升高到+6价。设元素X在还原产物中的化合价为x,则有3×(6-4)=2×(7-x),解得x=4,则元素X反应后的产物化合价为+4价。
①找出氧化剂、还原剂及相应的氧化产物和还原产物。 ②找准一个原子或一个离子得失电子数(注意化学式中的粒子个数)。 ③列等式:氧化剂数×变价原子数×化合价变化值(高价-低价)=还原剂数×变价原子数×化合价变化值(高价-低价)。
任务二、已知如下反应:①2BrO3-+Cl2===Br2+2ClO3(-),②ClO3-+5Cl-+6H+===3Cl2+3H2O,③2FeCl3+2KI===2FeCl2+2KCl+I2,④2FeCl2+Cl2===2FeCl3。如何利用“强弱规律”快速判断有关物质氧化性或还原性的强弱?
在氧化还原反应中,若氧化剂和还原剂及还原产物和氧化产物分为不同的物质时,氧化剂和氧化产物均具有氧化性,且氧化性:氧化剂>氧化产物,还原剂和还原产物均具有还原性,且还原性:还原剂>还原产物。
先找出同一反应中的氧化剂和氧化产物比较氧化性及同一反应中的还原剂和还原产物比较还原性,再根据不等式的传递性不同反应中有关物质的氧化性和还原性的强弱,得出结论。
反应①中氧化剂是BrO3-、氧化产物是ClO3-,则氧化性BrO3->ClO3-;同理,由反应②知,氧化性ClO3->Cl2;由反应③知,氧化性Fe3+>I2,由反应④知,氧化性Cl2>Fe3+;综上可知,氧化性为BrO3->ClO3->Cl2>Fe3+>I2。同理,可比较有关物质还原性的强弱。
任务三、阅读教材P26页最后自然段,回答氧化还原反应在生活中有哪些应用? 并尝试对红酒中添加二氧化硫的原因作出解释。
常加少量二氧化硫防止红酒被氧化而变质,又称抗氧化剂。同时,二氧化硫还有一定的杀菌和稳定酸度的作用。
任务四、结合教材P26页“思考与讨论”可知,汽车尾气产生的NOx (主要指NO、和NO2)和CO均为有毒气体,容易对环境造成污染,思考如何有效消除汽车尾气污染以实现保护环境的目的?
①氮的所有氧化物(NOx)、CO均为有毒气体,而N2是无毒气体,且NOx具有氧化性,CO具有还原性。
②NO(NOx)和CO在催化剂作用下可以发生反应,生成无毒的CO2和N2。
③处理方法是通过加装汽车尾气催化转化装置,利用NOx的氧化性和CO的还原性,将有毒的NO (NOx)、CO,转化为无毒的CO2和N2后排放。反应原理如下:
还原剂 氧化剂 氧化产物 还原产物
2CO + 2NO === 2CO2 + N2
【典例1】人体正常的血红蛋白中应含有Fe2+。若误食亚硝酸钠,则导致血红蛋白中Fe2+转化为高铁血红蛋白而中毒。服用维生素C可解除亚硝酸钠中毒。下列叙述中正确的是( ) A.亚硝酸钠表现还原性 B.维生素C表现了还原性 C.亚硝酸钠被氧化 D.维生素C作为氧化
【解析】血红蛋白中含有的Fe2+有和亚硝酸钠反应转化为高铁血红蛋白,Fe2+化合价升高,作为还原剂,具有还原性,被氧化;亚硝酸钠体现氧化性,被还原。维生素C可解除亚硝酸钠中毒,原理是将高铁血红蛋白中的铁元素还原为Fe2+,维生素C具有还原性。
【典例2】近年来随着汽车数量的大幅增长,空气污染越来越严重。汽车尾气装置中,气体在催化转化器中的催化转化过程如图所示。下列说法正确的是( ) A.催化转化反应中NO为氧化剂,N2为氧化产物 B.催化转化反应中氧化剂与还原剂的个数相等 C.催化转化后将生成的CO2处理吸收后尾气才能排放 D.催化转化反应中氧化产物与还原产物的个数相等
1.下列各组物质中的氮元素,都既有氧化性又有还原性的是( ) A.N2、NO2 B.NH3、NO C.NH4Cl、N2O D.HNO3、N2O4
【解析】N元素的最高价为+5,最低价为-3,所以,化合价介于-3、+5之间的物质都既有氧化性又有还原性。答案为A。
2.关于反应2NaClO3+Na2SO3+H2SO4 = 2ClO2↑+2Na2SO4+H2O,说法正确的是( ) A.H2SO4是还原剂 B.Na2SO3是氧化剂 C.NaClO3中氯元素被氧化 D.氧化性:NaClO3>Na2SO4
【解析】H2SO4中元素化合价不变,H2SO4既不是氧化剂又不是还原剂,故A错误;Na2SO3中S元素化合价升高,Na2SO3是还原剂,故B错误;反应,NaClO3中氯元素化合价降低,NaClO3是氧化剂,氯元素被还原,故C错误;选项D,NaClO3中氯元素化合价降低,NaClO3是氧化剂;Na2SO3中S元素化合价升高,Na2SO3是还原剂,氧化产物为Na2SO4,氧化性:NaClO3>Na2SO4,故D正确。答案为D。
【解析】.该反应中,碳夺取了SnO2中的氧,C体现了还原性,故A选项正确。该化学反应后,有一氧化碳气体生成,固体质量减小,故B选项正确。SnO2在该过程中失去了氧,发生了还原反应,故C选项错误。一氧化碳有毒,会污染空气,可以用气球收集来进行尾气处理,故D选项正确。故选:C。
4.氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为SO2+2H2O—2e-→SO42-+4H+;(2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为Cl2+2e-→2Cl-。在(1)和(2)反应中均会生成产物X,则X的化学式为( ) A. NaClO B.NaClO4 C. HClO2 D.ClO2
【解析】(1)反应中S元素的化合价升高,C元素的化合价降低,反应后Cl元素的化合价小于+5价;(2)反应中还原过程的反应式为Cl2+2e-→2Cl-,则亚氯酸钠(NaClO2)中Cl元素的化合价升高,反应后Cl元素的化合价大于+3价;在(1)和(2)反应中均会生成产物X,则X中Cl元素的化合价在+3~+5价之间,只有ClO2符合,其Cl元素的化合价为+4价。
氧化还原反应的规律及应用
人教版 (2019)必修 第一册第三节 氧化还原反应试讲课课件ppt: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161975_t3/?tag_id=26" target="_blank">第三节 氧化还原反应试讲课课件ppt</a>,共37页。PPT课件主要包含了物质失氧的反应,物质得氧的反应,C+O2CO2,氧化还原反应的概念,氧化还原反应,化合价规律,还记得,与四大反应的关系,一定不是氧化还原反应,氧化还原等内容,欢迎下载使用。
人教版 (2019)必修 第一册第三节 氧化还原反应获奖课件ppt: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161975_t3/?tag_id=26" target="_blank">第三节 氧化还原反应获奖课件ppt</a>,共32页。PPT课件主要包含了学习目标,课程讲授,对应训练,氧化还原反应等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一章 物质及其变化第二节 离子反应优质课ppt课件: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161973_t3/?tag_id=26" target="_blank">第一章 物质及其变化第二节 离子反应优质课ppt课件</a>,共33页。PPT课件主要包含了学习目标,课前导入,新课讲授,不同电解质比较,对应训练,离子共存,离子的检验,离子推断四原则,离子推断,离子反应的应用等内容,欢迎下载使用。













