





化学必修 第一册第三节 氧化还原反应优质课ppt课件
展开【考纲要求】1.了解氧化剂、还原剂、氧化产物和 还原产物的概念;2.能利用“双线桥”和“单线桥”分析 氧化还原反应,会标出电子转移的数目。3.知道常见的氧化剂、还原剂。
在氧化还原反应中,一种物质失去电子(或电子对偏离),必然同时有物质得到电子(或电子对偏向)。
在反应时,所含元素的化合价 ,即 的物质是还原剂;在反应时,所含元素的化合价 ,即 的物质是氧化剂;
失去电子(或电子对偏离)
得到电子(或电子对偏向)
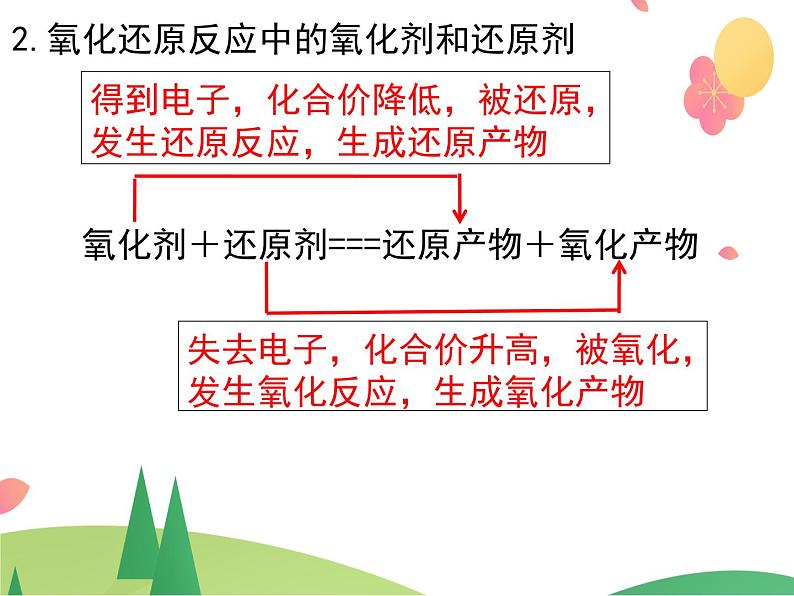
2.氧化还原反应中的氧化剂和还原剂
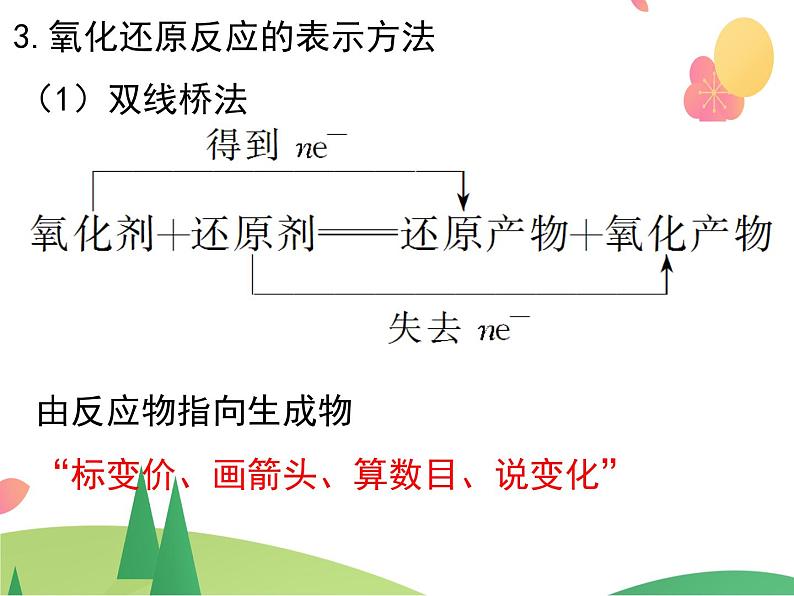
氧化剂+还原剂===还原产物+氧化产物
得到电子,化合价降低,被还原,发生还原反应,生成还原产物
失去电子,化合价升高,被氧化,发生氧化反应,生成氧化产物
【例题1】我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe + CuSO4 = Cu + FeSO4。有关该反应的说法正确的是( )A.Fe被还原 B.Fe是还原剂C.CuSO4发生氧化反应D.CuSO4失去电子【答案】B
3.氧化还原反应的表示方法
由反应物指向生成物“标变价、画箭头、算数目、说变化”
【例题2】 用双线桥分析下面的氧化还原反应 2CuO+C====2Cu+CO2↑
得到2×2e-,化合价降低,被还原
失去4e-,化合价升高,被氧化
注意:①箭头由反应物指向生成物②线桥连接同一元素③桥上标明“得到”“失去”字样,且注明得失电子总数
【练习】 用双线桥分析下面的氧化还原反应 Fe2O3 + 3CO ==== 2Fe + 3CO2
得到2×3e-,化合价降低,被还原
失去3×2e-,化合价升高,被氧化
单线桥法是用一条线桥来表示氧化还原反应中电子转移的方向和数目的方法。
反应物中,由失电子原子指向得电子原子,在线上只标转移电子总数,不标“得到”“失去”
【例题3】 用单线桥分析下面的氧化还原反应 2CuO+C====2Cu+CO2↑
注意:①箭头由反应物中的失电子元素指向反应物中的得电子元素②线桥不一定连接同一元素③桥上不标 “得到”“失去”字样,只需注明得失电子总数
二.常见的氧化剂和还原剂
1.常见的氧化剂常见的氧化剂有: ①典型的非金属单质, 如: F2、O2、Cl2、Br2 ②有变价元素的高价态化合物或离子, 如:KMnO4、浓H2SO4、HNO3、H+、HClO ③金属阳离子, 如:Fe3+、Cu2+
2.常见的还原剂常见的还原剂有:①典型的金属单质, 如:K、Ca、Na、Mg、Al ②某些非金属单质及其化合物, 如:H2、C、CO 、S ③有变价元素的最低价态化合物或离子, 如:H2S、HI、HBr, NH3、S2-、I-、Fe2+,Br-
3.具有中间价态原子的物质,既能表现氧化性,又能表现还原性例如: Fe Fe2+ Fe3+ ; H2O H2O2 O2 ; 0 +2 +3 -2 -1 0 S SO32- SO42- 0 +4 +6
【注意】(1)某元素由化合态变为游离态时,该元素可能被还原,也可能被氧化。(2)在氧化还原反应中,非金属单质不一定只做氧化剂。(3)所含元素价态越高,化合物的氧化性不一定越强。(4)在氧化还原反应中,一种元素被氧化,不一定有另一种元素被还原。
【例题4】Na2FeO4是一种高效多功能水处理剂,应用前景十分好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )A.Na2O2只作氧化剂B.FeSO4作还原剂C.铁元素被还原D.2ml FeSO4发生反应时,反应中共有 8ml电子转移
1.下列反应中,水只作氧化剂的是( )A、2F2+2H2O====4HF+O2 B、2Na+2H2O====2NaOH+H2↑C、2H2O ====2H2↑+O2↑ D、Na2O+H2O====2NaOH【答案】B
2.(双选)在反应 2KMnO4====K2MnO4+MnO2+O2↑中,还原产物是( )A、K2MnO4 B、MnO2 C、O2 D、KMnO4【答案】AB
3.CaH2常作生氢剂,其中氢元素呈-1价, 其化学方程式为CaH2+2H2O=Ca(OH)2+ 2H2↑ ,在该反应中水是( )A、还原剂 B、氧化剂C、既是还原剂又是氧化剂 D、既不是氧化剂又不是还原剂【答案】B
4.在反应Fe2O3 + 3CO====2Fe + 3CO2中,___________是氧化剂,___________是还原剂; __________元素被氧化,________ 元素被还原; __________是氧化产物, ________是还原产物。【答案】Fe2O3 ;CO ; C ; Fe ; CO2 ; Fe
5.(1)用双线桥分析下列氧化还原反应化合价的变化,标出电子转移的方向和数目,指出氧化剂和还原剂,氧化产物和还原产物。 ①2Al + 6HCl ==2AlCl3 + 3H2↑ ②H2S + H2SO4(浓) = S↓ + SO2↑+ 2H2O
(2)用单线桥法分析下列氧化还原反应电子转移情况与数目,指出氧化剂和还原剂,氧化产物和还原产物。①2F2 + 2H2O= 4HF +O2 ②2Na+2H2O =2NaOH+ H2↑
高中化学第三节 氧化还原反应课堂教学课件ppt: 这是一份高中化学<a href="/hx/tb_c161975_t3/?tag_id=26" target="_blank">第三节 氧化还原反应课堂教学课件ppt</a>,共30页。PPT课件主要包含了考纲要求,氧化剂和还原剂,1双线桥法,由反应物指向生成物,得到2×2e-,失去4e-,得到2×3e-,失去3×2e-,2单线桥法,元素化合价的判断等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教学课件ppt,共14页。PPT课件主要包含了素养发展目标,氧化剂,还原剂,氧化产物,还原产物,MnO2,HCl,MnCl2,Cl2,思考交流等内容,欢迎下载使用。
化学必修 第一册第三节 氧化还原反应背景图课件ppt: 这是一份化学必修 第一册第三节 氧化还原反应背景图课件ppt,共19页。PPT课件主要包含了维生素C,还原产物,氧化剂,归纳总结,练一练,FeCl3,FeCl2,Cl2,还原性,氧化性等内容,欢迎下载使用。













