




化学必修 第一册第三节 氧化还原反应优秀课件ppt
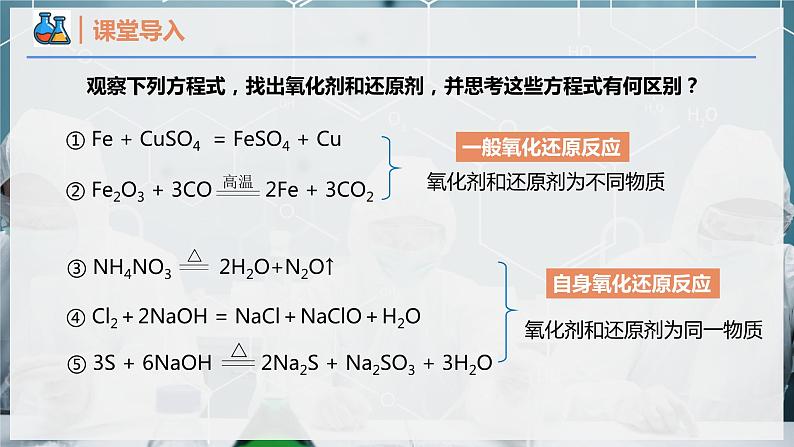
展开① Fe + CuSO4 = FeSO4 + Cu
⑤ 3S + 6NaOH
2Na2S + Na2SO3 + 3H2O
④ Cl2+2NaOH = NaCl+NaClO+H2O
氧化剂和还原剂为不同物质
氧化剂和还原剂为同一物质
观察下列方程式,找出氧化剂和还原剂,并思考这些方程式有何区别?
思考:同为自身氧化还原反应,第③个和第④⑤个有什么区别吗?
④⑤的氧化剂和还原剂是同一种物质
③的氧化产物和还原产物是同一种物质
⑥ H2S + H2SO4 = S↓ + SO2↑ + 2H2O
元素的两种化合价向中间靠拢
观察下列方程式,变价元素的化合价,是否全部发生了变化?
⑧ 3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑ + 4H2O
⑨ MnO2 + 4HCl(浓)
MnCl2 + 2H2O + Cl2↑
8个HNO3中只有_______个作氧化剂
4个HCl中只有________个作还原剂
对于部分氧化还原反应,氧化剂(还原剂)中被还原(氧化)与未被还原(氧化)的比例,要依据化学方程式或得失电子数来确定,只有被还原(氧化)的那部分才作氧化剂(还原剂)。
(1)电子守恒:氧化剂和还原剂得失电子总数相等,化合价升高总数 = 化合价降低总数。
①“一找各物质”:找出氧化剂、还原剂及相应的还原产物和氧化产物。②“二定得失数”:确定一个原子或离子得失电子数(注意化学式中原子的个数)。③“三列关系式”:根据题中物质的物质的量和电子守恒列出等式。
n(氧化剂)×变价原子个数×化合价变化值=n(还原剂)×变价原子个数×化合价变化值
(2)质量守恒:反应前后原子的种类和个数不变。(3)电荷守恒:离子反应前后,所带电荷总数相等。
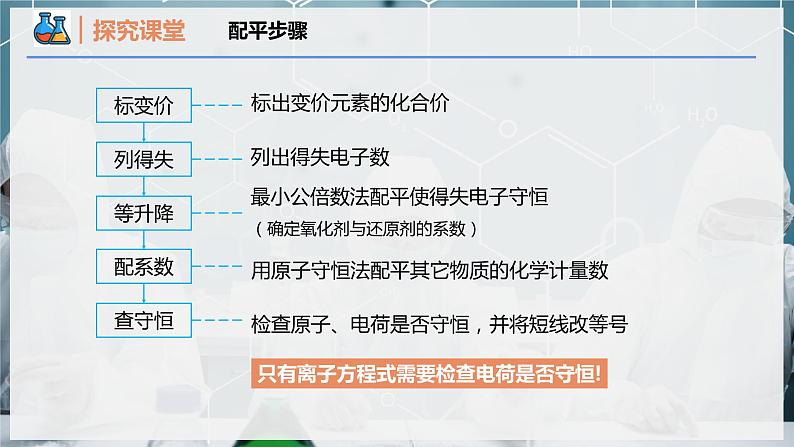
最小公倍数法配平使得失电子守恒(确定氧化剂与还原剂的系数)
用原子守恒法配平其它物质的化学计量数
检查原子、电荷是否守恒,并将短线改等号
只有离子方程式需要检查电荷是否守恒!
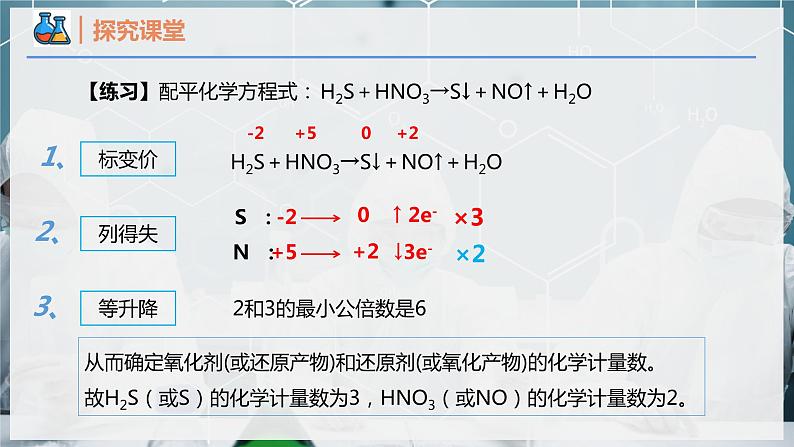
【练习】配平化学方程式:
H2S+HNO3→S↓+NO↑+H2O
-2 +5 0 +2
2和3的最小公倍数是6
从而确定氧化剂(或还原产物)和还原剂(或氧化产物)的化学计量数。故H2S(或S)的化学计量数为3,HNO3(或NO)的化学计量数为2。
H2S+ HNO3→ S↓+ NO↑+ H2O
先配平变价元素,再利用原子守恒配平其他元素。
最后利用O原子守恒来进行验证。
_____C + _____H2SO4(浓) —— _____CO2↑+ _____H2O + _____SO2↑
____ FeCl3 + _____ H2S —— _____ FeCl2 + ____HCl + _____S↓
全变左边配:某元素化合价完全变化,先配氧化剂与还原剂的个数
_____KI + _____KIO3 + _____H2SO4 —— _____K2SO4 + _____I2 + _____H2O
_____NH3 + _____NO —— _____N2 + _____H2O
_____S + _____NaOH —— _____Na2S + _____Na2SO3 + _____H2O
_____NO2 + _____H2O —— _____HNO3 + _____NO
自变右边配:自身的氧化还原反应,先配氧化产物与还原产物
_____HNO3 —— _____NO2↑+ _____O2↑+ _____H2O
部分变两边配:某元素化合价部分变化,配该元素的生成物
_____ Cu + _____H2SO4(浓) —— _____ CuSO4 + _____SO2↑+ _____H2O
_____Fe + _____HNO3(稀) —— _____Fe(NO3)3 + _____NO↑+ _____H2O
整体配平法:将都升高或降低的两种或多种元素看做一个整体
(1) FeS2+ O2= Fe2O3+ SO2
+2 -1 0 +3 +4 -2
(2) Cu2S+ HNO3= Cu(NO3)2+ H2SO4+ NO↑+ H2O
Fe2+ + MnO4- + H+ —— Mn2+ + Fe3+ + H2O
5 1 8 1 5 4
Cr2O72-+ H2O2+ H+ —— CrO5+ H2O
1 4 2 2 5
Cr2O72- + Fe2+ + ( ) → Cr3+ + Fe3+ + H2O
① 先配氧化剂、还原剂及还原产物与氧化产物;
② 再根据质量守恒、电荷守恒确定所缺的物质的化学式(分子或离子) 若反应物这边缺正电荷,一般加H+,生成物一边加水; 若反应物这边缺负电荷,一般加OH-,生成物一边加水;
③ 观察配平其他物质系数。
1 6 14 H+ 2 6 7
NaBiO3+ Mn2++ → Na++ Bi3++ +
【练习】将NaBiO3固体(黄色,微溶)加入MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的例子方程式
Bi(+5→+3) 2×5(化学计量数5配在NaBiO3和Bi3+前)
Mn(+2→+7)5×2(化学计量数2配在Mn2+和MnO4-前)
(2) 据补项原则,在酸性条件下,方程式左边多O,故应补H+,而方程式右边少O,故应补H2O,再根据原子守恒配平H+和H2O之前的化学计量数
(1) 由溶液显紫色可推知有MnO4-生成,确定变价元素物质的化学计量数:
电子守恒、质量守恒、电荷守恒
标变价、列得失等升降、配系数查守恒
全变左边配自变右边配部分变两边配整体配平法缺项配平
【练习1】配平下列方程式 (1) HCl(浓)+ MnO2 Cl2↑+ MnCl2+ H2O (2) KI+ KIO3+ H2SO4= I2+ K2SO4+ H2O (3) MnO4-+ H++ Cl-= Mn2++ Cl2↑+ H2O
【练习2】配平下列方程式 (1) S+ KOH= K2S+ K2SO3+ H2O (2) P4+ KOH+ H2O= K3PO4+ PH3
【练习3】请配平下列离子方程式。(1) 在酸性条件下,K2Cr2O7与FeSO4反应的离子方程式为 ____Cr2O72-+ ___Fe2++___ ______=____Cr3++___Fe3++___H2O,(2) 在酸性条件下,SO2通入FeCl3溶液中反应离子方程式为 ___Fe3++___SO2+___ _____=___Fe2++___SO42- +___ ___
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应优质ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应优质ppt课件,共24页。PPT课件主要包含了守恒规律,先后规律,价态规律,本节重点,本节难点,电子守恒规律,Fe2+,Fe3+,常见的强弱顺序,既有氧化性也有还原等内容,欢迎下载使用。
人教版 (2019)第三节 氧化还原反应精品ppt课件: 这是一份人教版 (2019)第三节 氧化还原反应精品ppt课件,共27页。PPT课件主要包含了双线桥法表示电子转移,本节重点,本节难点,氧化反应,Fe2O3,还原反应,得氧失氧,思考与讨论,发生了氧化反应,发生了还原反应等内容,欢迎下载使用。
高中人教版 (2019)第三节 氧化还原反应试讲课ppt课件: 这是一份高中人教版 (2019)第三节 氧化还原反应试讲课ppt课件,文件包含第08讲氧化还原反应的分类及其配平PPT课件pptx、第08讲氧化还原反应的分类及其配平教师版docx、第08讲氧化还原反应的分类及其配平学生版docx等3份课件配套教学资源,其中PPT共32页, 欢迎下载使用。













