






还剩13页未读,
继续阅读
2023年中考九年级化学复习专题第九单元溶液课件PPT
展开
这是一份2023年中考九年级化学复习专题第九单元溶液课件PPT,共21页。
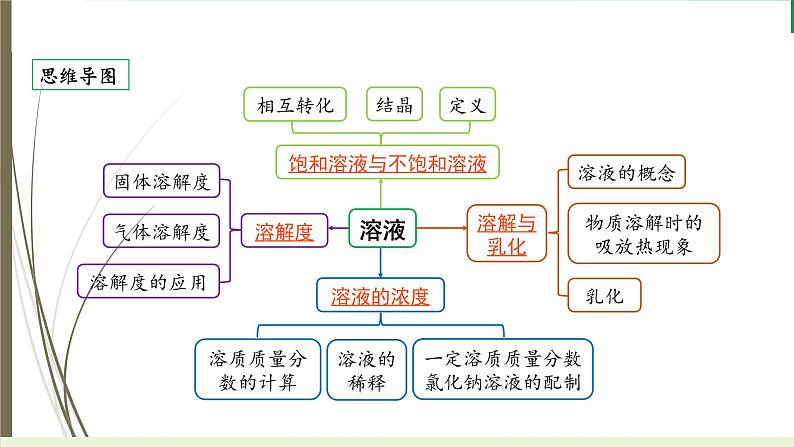
第九单元 溶 液思维导图溶液溶质:被溶解的物质,可以是固体,也可以是液体或气体溶剂:能溶解其他物质的物质,____是最常 见的溶剂,酒精、汽油等也可作溶剂一、溶解与乳化[2022.6A、11B,2014.7B、13(2)③]溶解溶液定义:一种或几种物质分散到另一种物质里,形成______的、______的 混合物特征:________、________组成吸热,如_________放热,如 、浓硫酸无明显吸放热现象,如NaCl物质溶解时的吸放热现象均一稳定均一性稳定性水NH4NO3NaOH一、溶解与乳化[2022.6A、11B,2014.7B、13(2)③]乳化乳化现象:洗涤剂等乳化剂能使植物油等在水中分散成无数细小的液滴, 而不聚集成大的油珠,使油和水不再分层,这种现象称为乳化应用:除去餐具上的油污是利用了洗涤剂的__________乳化作用二、饱和溶液与不饱和溶液(10年6考)定义:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所 得到的溶液叫做这种溶质的__________;当溶质还能继续溶解时所形成的溶 液叫做这种溶质的____________相互转化所有物质:不饱和溶液饱和溶液溶解度随温度升高而增大的物质:不饱和溶液饱和溶液溶解度随温度升高而减小的物质:不饱和溶液饱和溶液饱和溶液不饱和溶液增加溶剂__________:适用于溶解度受温度变化影响较小的物质,如氯化钠__________:适用于溶解度随温度升高而显著增大的物质,如硝酸钾二、饱和溶液与不饱和溶液(10年6考)结晶定义:溶质从溶液中以_______的形式析出的过程方法晶体蒸发结晶降温结晶三、溶解度(10年9考,仅2018年未考)固体物质溶解度定义:在__________下,某固体物质在______g溶剂里达到_________ 时所溶解的_______影响因素内因:溶质、溶剂的性质外因:温度气体物质溶解度定义:在压强为101 kPa和一定温度时,该气体在1体积水里溶解达到 饱和状态时的气体_______外界影响因素:主要是温度和压强(压强一定时,温度升高,溶解度 ______;温度一定时,压强增大,溶解度______)溶解度的应用:详见精练本微专题7一定温度100饱和状态质量体积减小增大原理:稀释前后,_________不变公式:A×a%=B×b%(其中a%、b%分别为稀释前后溶质的质量分 数,A、B分别为稀释前后溶液的质量,即B=A+加入水的质量)四、溶液的浓度(10年9考,仅2014年未考)溶质质量分数的计算所有溶液:饱和溶液:溶液的稀释一定溶质质量分数溶液的配制:详见纵横过实验栏目溶液质量溶质质量溶剂质量溶质质量判断下列说法的正误,正确的请在括号内打“√”,错误的请打“×”。1. 溶液是均一、稳定的液体,则均一、稳定的液体一定是溶液。( )2. 溶液都是无色透明的。( )3. 将氧化钙溶于水后得到氧化钙溶液。( )4. 用汽油洗涤衣服上的油污利用了汽油的乳化作用。( )5. 氯化钠的饱和溶液不能继续溶解其他物质。( )6. 饱和溶液一定是该物质的浓溶液。( )××××××7. 析出晶体后的溶液一定是该物质在该温度下的饱和溶液。( )8. 升高温度,饱和溶液一定变为不饱和溶液,降低温度,不饱和溶液一定变为饱和溶液。( )9. 有晶体析出的溶液其溶质质量分数一定减小。( )10. 配制溶液时,搅拌可以增大固体物质的溶解度。( )√×××纵向实验逐个过1. 甲组同学在实验室用氯化钠固体配制100 g溶质质量分数为6%的氯化钠溶液。实验步骤如下图,请回答下列问题。【实验仪器】(1)实验需要的仪器有托盘天平(含砝码)、药匙、_______、烧杯、______和胶头滴管。玻璃棒量筒【实验步骤及操作】(2)计算:实验中称量___ g氯化钠固体,需要量取_____mL水。(3)称量:往左盘慢慢加入氯化钠的过程中,发现指针偏左,接下来应该进行的操作是________________________________。(4)量取:量取水时,用到的仪器为量筒和__________,最好选用_______(填“50 mL”“100 mL”或“200 mL”)的量筒。694取出左盘部分药品,直至天平平衡胶头滴管100 mL(5)溶解:该操作中玻璃棒的作用是_________________。(6)装瓶、贴标签:同学们将配制好的溶液装瓶后贴上标签,请你在图中标签上填写相应的内容:搅拌,加速溶解6%NaCl溶液【偏差分析】(7)经测定,所配溶液的溶质质量分数小于6%,可能的原因是_________(填序号)。①称量前天平未调零,指针向右偏 ②砝码生锈或沾有污渍③氯化钠固体中含有杂质 ④称量时“左码右物”,并且使用了游码⑤将氯化钠转移到烧杯中,称量纸上有残留固体⑥量取水时仰视读数⑦将量取的水倒入烧杯中时有水溅出③④⑤⑥(8)(2021邵阳改编)乙组同学对甲组同学的实验进行分析,其中操作及目的分析均正确的是____(填字母序号)。A. 称取氯化钠时,在两边托盘上各放一张相同的纸张——整洁美观B. 称取氯化钠时,将剩余的氯化钠进行回收处理,放回原瓶——节约药品C. 量取水时,视线与量筒内液体凹液面的最低处保持水平——准确读数D. 溶解氯化钠时,用玻璃棒搅拌——增大氯化钠的溶解度C(9)[形式创新]丙组同学配制50 g质量分数为5%的KNO3溶液作为无土栽培所需的营养液。溶解过程中KNO3的质量分数随时间的变化关系如图所示,分析形成这种结果的原因是____(填字母序号)。A. 所用KNO3固体中含有水分B. 量筒量水时俯视刻度线C. KNO3固体溶解前所用烧杯内有水D. 配好的溶液装瓶时部分液体洒落到试剂瓶外B溶质质量分数的偏差分析大小小大溶质质量分数偏大溶质质量分数偏小m溶质偏____m溶剂偏____m溶质偏____m溶剂偏____2. 小明同学用氯化钠浓溶液稀释配制100 g溶质质量分数为6%的氯化钠溶液。(1)实验步骤为计算、______、______、装瓶。(2)需要10%氯化钠溶液的质量为____g,需要水的体积为____mL。量取混匀6040(3)[画图](2022温州改编)小华同学欲将50 mL溶质质量分数为10%的蔗糖溶液加水稀释为5%(已知:稀释后溶液密度变小),图甲为稀释前溶液的模型,其中5个“。”代表所有的蔗糖分子,请在图乙中补充完成稀释后的蔗糖溶液模型(要求画出液面和蔗糖分子分布)。(4)[日常生活情境](2020福建改编)小天同学经查阅资料发现,餐具可以用有效氯的质量分数为0.04%的84消毒液浸泡,20 min后用生活饮用水冲净即可。现将有效氯的质量分数为6.0%的84消毒液与水按质量比为1∶______进行稀释,即可用于餐具消毒。149
第九单元 溶 液思维导图溶液溶质:被溶解的物质,可以是固体,也可以是液体或气体溶剂:能溶解其他物质的物质,____是最常 见的溶剂,酒精、汽油等也可作溶剂一、溶解与乳化[2022.6A、11B,2014.7B、13(2)③]溶解溶液定义:一种或几种物质分散到另一种物质里,形成______的、______的 混合物特征:________、________组成吸热,如_________放热,如 、浓硫酸无明显吸放热现象,如NaCl物质溶解时的吸放热现象均一稳定均一性稳定性水NH4NO3NaOH一、溶解与乳化[2022.6A、11B,2014.7B、13(2)③]乳化乳化现象:洗涤剂等乳化剂能使植物油等在水中分散成无数细小的液滴, 而不聚集成大的油珠,使油和水不再分层,这种现象称为乳化应用:除去餐具上的油污是利用了洗涤剂的__________乳化作用二、饱和溶液与不饱和溶液(10年6考)定义:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所 得到的溶液叫做这种溶质的__________;当溶质还能继续溶解时所形成的溶 液叫做这种溶质的____________相互转化所有物质:不饱和溶液饱和溶液溶解度随温度升高而增大的物质:不饱和溶液饱和溶液溶解度随温度升高而减小的物质:不饱和溶液饱和溶液饱和溶液不饱和溶液增加溶剂__________:适用于溶解度受温度变化影响较小的物质,如氯化钠__________:适用于溶解度随温度升高而显著增大的物质,如硝酸钾二、饱和溶液与不饱和溶液(10年6考)结晶定义:溶质从溶液中以_______的形式析出的过程方法晶体蒸发结晶降温结晶三、溶解度(10年9考,仅2018年未考)固体物质溶解度定义:在__________下,某固体物质在______g溶剂里达到_________ 时所溶解的_______影响因素内因:溶质、溶剂的性质外因:温度气体物质溶解度定义:在压强为101 kPa和一定温度时,该气体在1体积水里溶解达到 饱和状态时的气体_______外界影响因素:主要是温度和压强(压强一定时,温度升高,溶解度 ______;温度一定时,压强增大,溶解度______)溶解度的应用:详见精练本微专题7一定温度100饱和状态质量体积减小增大原理:稀释前后,_________不变公式:A×a%=B×b%(其中a%、b%分别为稀释前后溶质的质量分 数,A、B分别为稀释前后溶液的质量,即B=A+加入水的质量)四、溶液的浓度(10年9考,仅2014年未考)溶质质量分数的计算所有溶液:饱和溶液:溶液的稀释一定溶质质量分数溶液的配制:详见纵横过实验栏目溶液质量溶质质量溶剂质量溶质质量判断下列说法的正误,正确的请在括号内打“√”,错误的请打“×”。1. 溶液是均一、稳定的液体,则均一、稳定的液体一定是溶液。( )2. 溶液都是无色透明的。( )3. 将氧化钙溶于水后得到氧化钙溶液。( )4. 用汽油洗涤衣服上的油污利用了汽油的乳化作用。( )5. 氯化钠的饱和溶液不能继续溶解其他物质。( )6. 饱和溶液一定是该物质的浓溶液。( )××××××7. 析出晶体后的溶液一定是该物质在该温度下的饱和溶液。( )8. 升高温度,饱和溶液一定变为不饱和溶液,降低温度,不饱和溶液一定变为饱和溶液。( )9. 有晶体析出的溶液其溶质质量分数一定减小。( )10. 配制溶液时,搅拌可以增大固体物质的溶解度。( )√×××纵向实验逐个过1. 甲组同学在实验室用氯化钠固体配制100 g溶质质量分数为6%的氯化钠溶液。实验步骤如下图,请回答下列问题。【实验仪器】(1)实验需要的仪器有托盘天平(含砝码)、药匙、_______、烧杯、______和胶头滴管。玻璃棒量筒【实验步骤及操作】(2)计算:实验中称量___ g氯化钠固体,需要量取_____mL水。(3)称量:往左盘慢慢加入氯化钠的过程中,发现指针偏左,接下来应该进行的操作是________________________________。(4)量取:量取水时,用到的仪器为量筒和__________,最好选用_______(填“50 mL”“100 mL”或“200 mL”)的量筒。694取出左盘部分药品,直至天平平衡胶头滴管100 mL(5)溶解:该操作中玻璃棒的作用是_________________。(6)装瓶、贴标签:同学们将配制好的溶液装瓶后贴上标签,请你在图中标签上填写相应的内容:搅拌,加速溶解6%NaCl溶液【偏差分析】(7)经测定,所配溶液的溶质质量分数小于6%,可能的原因是_________(填序号)。①称量前天平未调零,指针向右偏 ②砝码生锈或沾有污渍③氯化钠固体中含有杂质 ④称量时“左码右物”,并且使用了游码⑤将氯化钠转移到烧杯中,称量纸上有残留固体⑥量取水时仰视读数⑦将量取的水倒入烧杯中时有水溅出③④⑤⑥(8)(2021邵阳改编)乙组同学对甲组同学的实验进行分析,其中操作及目的分析均正确的是____(填字母序号)。A. 称取氯化钠时,在两边托盘上各放一张相同的纸张——整洁美观B. 称取氯化钠时,将剩余的氯化钠进行回收处理,放回原瓶——节约药品C. 量取水时,视线与量筒内液体凹液面的最低处保持水平——准确读数D. 溶解氯化钠时,用玻璃棒搅拌——增大氯化钠的溶解度C(9)[形式创新]丙组同学配制50 g质量分数为5%的KNO3溶液作为无土栽培所需的营养液。溶解过程中KNO3的质量分数随时间的变化关系如图所示,分析形成这种结果的原因是____(填字母序号)。A. 所用KNO3固体中含有水分B. 量筒量水时俯视刻度线C. KNO3固体溶解前所用烧杯内有水D. 配好的溶液装瓶时部分液体洒落到试剂瓶外B溶质质量分数的偏差分析大小小大溶质质量分数偏大溶质质量分数偏小m溶质偏____m溶剂偏____m溶质偏____m溶剂偏____2. 小明同学用氯化钠浓溶液稀释配制100 g溶质质量分数为6%的氯化钠溶液。(1)实验步骤为计算、______、______、装瓶。(2)需要10%氯化钠溶液的质量为____g,需要水的体积为____mL。量取混匀6040(3)[画图](2022温州改编)小华同学欲将50 mL溶质质量分数为10%的蔗糖溶液加水稀释为5%(已知:稀释后溶液密度变小),图甲为稀释前溶液的模型,其中5个“。”代表所有的蔗糖分子,请在图乙中补充完成稀释后的蔗糖溶液模型(要求画出液面和蔗糖分子分布)。(4)[日常生活情境](2020福建改编)小天同学经查阅资料发现,餐具可以用有效氯的质量分数为0.04%的84消毒液浸泡,20 min后用生活饮用水冲净即可。现将有效氯的质量分数为6.0%的84消毒液与水按质量比为1∶______进行稀释,即可用于餐具消毒。149
相关资料
更多










