



人教版 (2019)必修 第二册第三节 乙醇与乙酸课文内容课件ppt
展开1. 掌握乙醇的结构及其主要性质与应用。2.认识有机化合物中的羟基与性质的关系。
联系生活归纳乙醇的物理性质
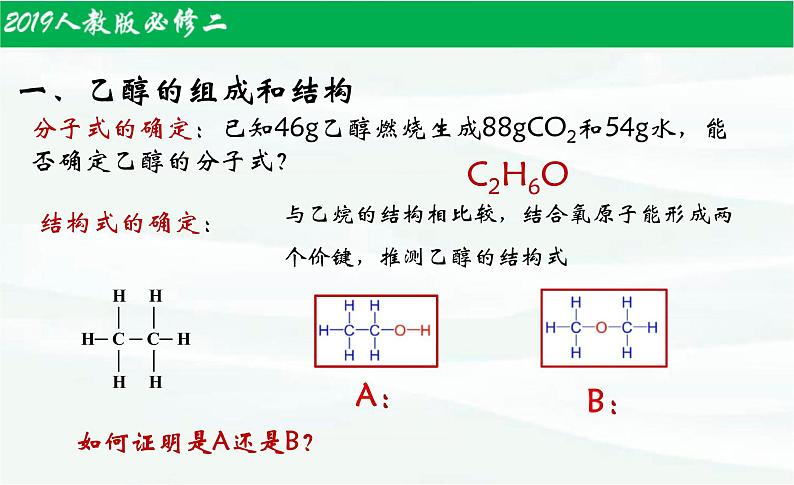
分子式的确定:已知46g乙醇燃烧生成88gCO2和54g水,能否确定乙醇的分子式?
与乙烷的结构相比较,结合氧原子能形成两个价键,推测乙醇的结构式
H H │ │H─ C ─ C─ H │ │ H H
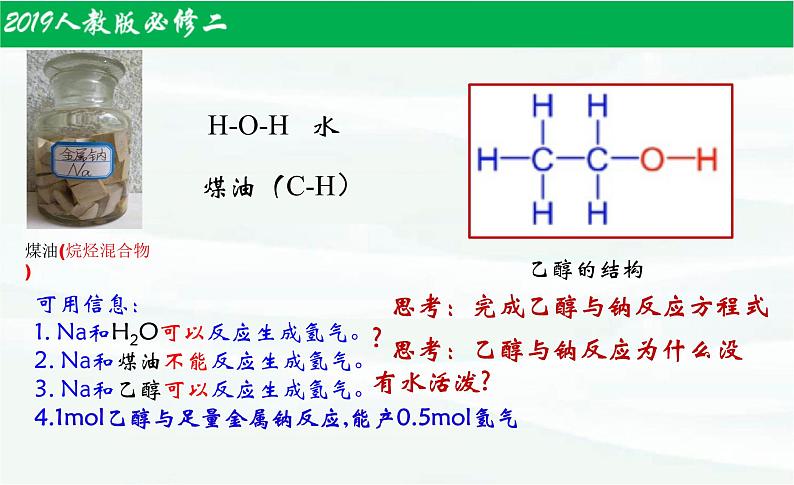
1、钠下沉(钠的密度比乙醇的大)2、缓慢放出气泡,且钠不熔化,在底部(或悬浮)慢慢消失3、点燃生成的气体,产生淡蓝色火焰,烧杯内壁有水雾,澄清石灰水不变浑浊。(有氢气生成)
可用信息:1. Na和H2O可以反应生成氢气。2. Na和煤油不能反应生成氢气。3. Na和乙醇可以反应生成氢气。4.1ml乙醇与足量金属钠反应,能产0.5ml氢气
思考:乙醇与钠反应为什么没有水活泼?
思考:完成乙醇与钠反应方程式?
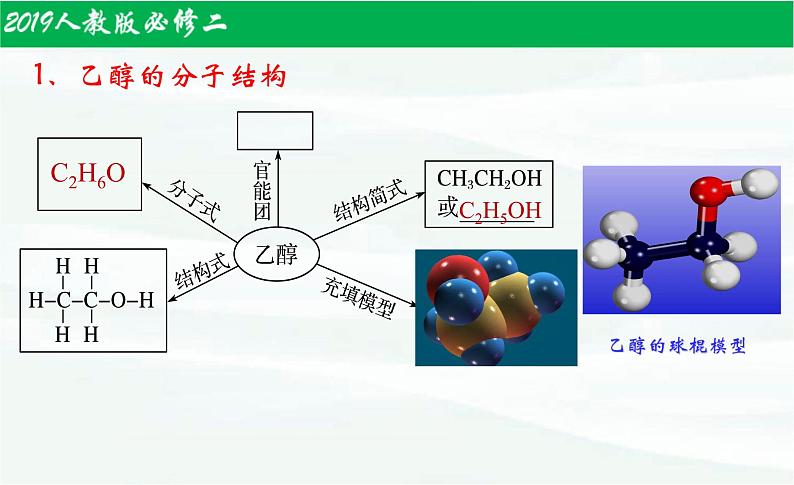
乙醇可以看成是乙烷中的一个氢原子被羟基取代以后的产物,属于烃的衍生物。
乙醇的官能团 羟基
烃分子失去一个中氢原子所剩余的原子团叫烃基。CH3—甲基,CH3CH2—乙基
烃的衍生物:从结构上看,烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。列举两例以上。
2、烃的衍生物和官能团:
判断方法:出含有碳氢元素外还含有其他元素。
官能团:决定有机化合物的化学特性的原子或原子团。
思考:写出氢氧根的化学式和电子式,与羟基有什么区别
能独立存在于溶液或离子化合物中
不能单独存在,必须与其他原子或基结合
比水小 20℃时,密度是0.7893g/ml
跟水以任意比互溶能够溶解多种无机物和有机物,重要的有机溶剂。
易挥发,沸点78.5℃
加CaO,蒸馏。
思考:如何由工业酒精制备无水乙醇? 怎样检验无水乙醇中有水?
思考:为什么乙醇可以与水以任意比互溶?
钠与水反应剧烈。乙醇羟基中的氢原子不如水分子中的氢原子活泼
1、与活泼金属(如Na)反应
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
(置换反应,而非取代反应)。
思考:根据钠与乙醇、水反应的现象,比较羟基氢的活泼性。
思考:酸、乙醇、水与钠反应的速率顺序,为什么?
类比:其它活泼金属如钾、镁和铝等也可与乙醇反应,均可产生H2 ,请写出镁与乙醇反应的化学方程式。
1.关于乙醇结构与性质方面的说法中正确的是( )A.乙醇结构中有—OH,所以乙醇溶解于水,可以电离出OH-B.乙醇能电离出H+,所以是电解质C.乙醇与钠反应可以产生氢气,所以乙醇显酸性D.乙醇、水分别与钠,乙醇的反应比水更平缓
现象:乙醇在空气中燃烧,发出淡蓝色的火焰,烧杯壁上出现液滴, 生成的气体能使澄清石灰水变浑浊.
实验现象?写出有关的方程式,如何检验燃烧产物?
铜丝加热由红变黑,插入乙醇中,铜丝表面黑变红,试管中的液体有刺激性气味
(2)乙醇的催化氧化
思考:反应整个过程铜的作用是什么?
乙醛无色、有 刺 激 性 气 味的 液 体。
思考:该反应的本质断开什么键,形成什么键?
思考:结合断键,哪些醇可以发生催化氧化?
思考:根据乙醇催化氧化的实质,推测的CH3OH、 催化氧化产物是什么? 能被催化氧化吗?
(1)凡是含有R—CH2OH(R代表烃基)结构的醇,在一定条件下都能被氧化成醛(R—CHO)。(2)凡是含有R—CH(OH)—R′结构的醇,在一定条件下也能被氧化,但生成物不是醛,而是酮(R—CO—R′)。(3)凡是含有 结构的醇通常情况下不能被氧化。
练习:CH3OH、 催化氧化的方程式?
2.下列醇分子中可以被氧化生成醛的是( )。A.CH3OHB.(CH3)3C—OHC.CH3—O—CH3D.
3、催化氧化的产物是 的醇是( )。
银器焊接时很容易氧化变黑,银匠先把银在火上烧热,马上蘸一下酒精,焊接的银器光亮如新!这是何原理?
KMnO4(紫色)
MnSO4(无色)
K2Cr2O7 Cr2(SO4)3 重铬酸钾(橙色) 硫酸铬 (绿色)
酸性K2Cr2O7(aq)由橙色变为绿色,判定司机饮酒超标。
(3) 被强氧化剂氧化
练习:完成CH3CH2OH使酸性 KMnO4紫色褪去的方程式。
练习:完成CH3CH2OH使酸性 K2Cr2O7紫色褪去的方程式。
4.探究乙醇性质的实验中,下列描述正确的是( )A.金属钠沉在乙醇液面之下,熔化成小球,剧烈反应B.向乙醇的水溶液滴入几滴酚酞,溶液变红色C.将灼烧的铜丝伸入乙醇中,铜丝溶解,生成刺激性物质D.向乙醇中滴加酸性KMnO4溶液,紫红色褪去
有机物氧化反应的特点:
有机物加氧去氢,发生氧化反应。有机物加氢去氧,发生还原反应。
①用作酒精灯、火锅、内燃机等的燃料
②用作重要的有机化工原料和溶剂
④医疗上常用体积分数为75%的乙醇溶液作消毒剂
③用于生产医药、香料、化妆品、涂料等
乙醇属于火灾危险性物质。室内禁止喷洒式消毒方式,应采取擦拭方式;室外采取喷洒式消毒方式必须禁止明火。酒精可以凝固蛋白质并导致病原体死亡。过高浓度的酒精会在细菌表面形成一层保护膜,阻止其进入细菌体内,难以将细菌彻底杀死;若酒精浓度过低,虽可进入细菌,但不能将其体内的蛋白质凝固,同样也不能将细菌彻底杀死。因此,使用70%~75%的酒精,既能使组成细菌的蛋白质凝固,又不能形成包膜,能使酒精维续向内部渗造,而使其彻底消套杀菌。
资料卡片P79:了解酒精在人体中的变化
葡萄酒开瓶后,喝酒前要进行“醒酒”,但如果开瓶后多余的葡萄酒密封不够严实,时间久了就会发酸,你知道其中的科学原理吗?
A、醒酒原理:第一是去除葡萄酒中的沉淀,使杯中的酒看起来更靓丽。第二是让葡萄酒中的单宁(干涩感和细微的苦味)充分氧化,同时去除由SO2带来的异味,使葡萄酒本身的香气更具活力。
B、变酸原理:醇氧化为醛,醛氧化为酸。
5.某有机物的结构简式为 下列关于该有机物的叙述中,不正确的是( )A.能与金属钠发生反应并放出氢气B.能在催化剂作用下与H2发生加成反应C.不能使酸性KMnO4溶液褪色D.在铜作催化剂条件下能发生催化氧化反应生成醛
三、乙醇的化学性质 1.与活泼金属的置换反应 2.氧化反应(催化氧化、燃烧、强氧化剂)
1.下列有关乙醇物理性质的应用中不正确的是( )A.由于乙醇容易挥发,所以才有俗语“酒香不怕巷子深”的说法B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药中的有效成分C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒D.由于乙醇的密度比水小,所以乙醇会浮在水的上层
2.下列有关乙醇的表述正确的是( )A.乙醇分子中含有甲基,甲基的电子式为B.乙醇的结构简式为C2H6OC.乙醇分子中羟基的电子式为D.乙醇分子的空间充填模型为
4.已知分子中含有羟基的物质都能与钠反应产生氢气。
A.6∶3∶2B.1∶2∶3C.3∶2∶1D.4∶3∶2
3.决定乙醇主要化学性质的原子或原子团是( )A.羟基 B.乙基(—CH2CH3) C.氢氧根离子 D.氢离子
5.乙醇分子中有5种化学键,如图所示 ,在不同的反应中会有不同形式的化学键断裂,根据下列不同反应,按要求回答相关问题。(1)和金属钠反应,断裂的化学键为______(填断键序号,下同),化学方程式为_______________________________________。1 ml 乙醇和足量的金属钠反应,生成标准状况下的氢气为______L。
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
(2)乙醇在空气中充分燃烧,反应时断裂的化学键为_____________,反应的化学方程式为________________________________。
(3)①将弯成螺旋状的铜丝灼烧,铜丝变黑,反应原理为____________________(用化学方程式表示)。然后将灼热的铜丝插入乙醇中,铜丝表面由黑变红,在此过程中,乙醇分子中断裂的化学键为______,反应方程式为_________________________________________,整个过程反应总方程式为_________________________________________,铜在反应中起到_______作用。
化学选择性必修3实验活动1 乙酸乙酯的制备与性质一等奖ppt课件: 这是一份化学选择性必修3实验活动1 乙酸乙酯的制备与性质一等奖ppt课件
高中化学人教版 (2019)必修 第二册第三节 乙醇与乙酸教课内容课件ppt: 这是一份高中化学人教版 (2019)必修 第二册第三节 乙醇与乙酸教课内容课件ppt,共35页。PPT课件主要包含了学习目标,组成和结构,课堂练习,物理性质,化学性质,“酒是陈的香”,“美味佳肴”,实验现象,有机反应类型,乙酸的结构等内容,欢迎下载使用。
高中人教版 (2019)实验活动1 乙酸乙酯的制备与性质课文内容ppt课件: 这是一份高中人教版 (2019)实验活动1 乙酸乙酯的制备与性质课文内容ppt课件,共13页。PPT课件主要包含了酯化反应实质,同位素原子示踪法,实验仪器和药品,实验步骤,实验中的注意事项,酯化反应,属于取代反应,知识小结,实验小结,实验要点等内容,欢迎下载使用。













