





2020-2021学年第三节 氧化还原反应课文内容ppt课件
展开
这是一份2020-2021学年第三节 氧化还原反应课文内容ppt课件,共15页。PPT课件主要包含了炸药爆炸,价态规律,最低价态,化合价升高,还原性,最高价态,化合价降低,氧化性,中间价态,可升也可降等内容,欢迎下载使用。
2H2+O2=2H2O
某些宇宙飞船上所使用的氢氧燃料电池,不仅能量转换率高,而且电池反应生成的水还可供宇航员饮用。
4Fe + 3O2 + 6H2O = 4Fe(OH)3
食品包装袋内的脱氧剂。
隐形眼镜洗涤液的主要成分是双氧水。
2H2O2 = O2↑+ 2H2O
人体血液中葡萄糖与O2发生有氧呼吸作用:
C6H12O6 + 6O2 = 6CO2+6H2O
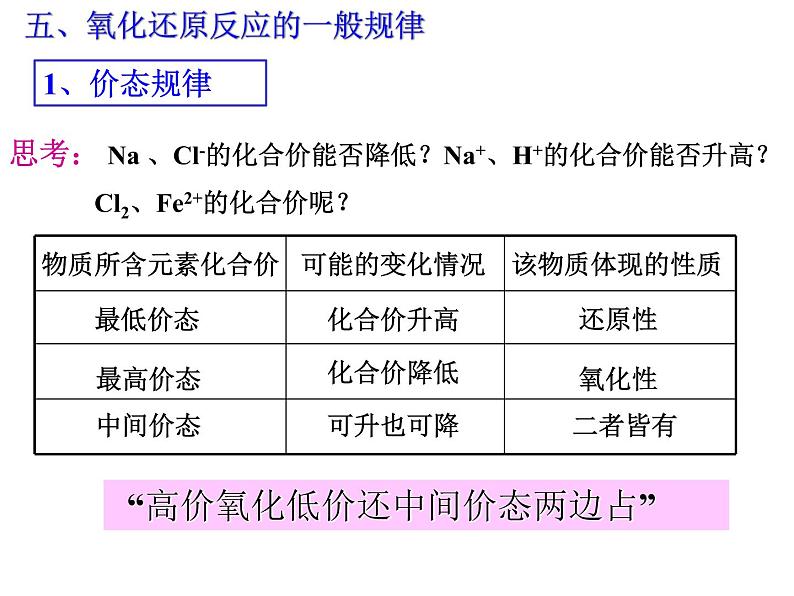
五、氧化还原反应的一般规律
思考: Na 、Cl-的化合价能否降低?Na+、H+的化合价能否升高? Cl2、Fe2+的化合价呢?
“高价氧化低价还中间价态两边占”
1、在Fe2+、Fe3+、S、I-、H+中只有氧化性的是 ,只有还原性的是_______,既有氧化性又有还原性的是 。
2、下列变化中,必须要加入氧化剂才能实现的是( ) A、KMnO4→O2 B、HCl→Cl2 C、HCl→H2 D、SO3→H2SO4
3、下列说法中正确的是( ) A、处于最高价态的元素不一定具有强氧化性 B、元素由游离态转为化合态,说明该元素一定被氧化 C、阳离子只有氧化性,阴离子只有还原性 D、金属元素只有还原性,非金属元素只有氧化性
氧化性:得电子的难易还原性:失电子的难易
K …… Al Zn Fe Sn Pb(H)Cu Hg Ag ……
单质还原性逐渐减弱,失电子能力逐渐减弱
K+ …… Al3+ Zn2+ Fe2+ Sn2+ Pb2+(H +) Cu2+ Fe3+ Hg2+ Ag+
对应阳离子氧化性逐渐增强,得电子能力逐渐增强
氧化性:氧化剂 > 氧化产物还原性:还原剂 > 还原产物
例 Fe + CuSO4 == FeSO4 + Cu
练习:1、某条件下,有反应:
(1)2 A3+ + 3B = 2A + 3B2+(2)3D2+ + 2A = 2A3+ + 3D(3) B2+ + C = C2+ + B
① 判定 A、B、C、D的还原性由强到弱的顺序( ) A.A >B >C >D B.D >C >B >A C.C >B >A >D D.B >A >C >D
② 该条件下,反应 B2+ + D = D2+ + B能进行吗?
根据方程式判断根据金属活动顺序表判断根据反应条件或剧烈程度判断根据被氧化或被还原的程度判断
(3)氧化性还原性强弱判断:
一种氧化剂与多种还原剂相遇时,还原性强的优先反应一种还原剂与多种氧化剂相遇时,氧化性强的优先反应
得失电子守恒、化合价升降守恒
同种元素不同价态之间发生氧化还原反应,元素化合价只向中间靠拢,不交叉
讨论:用 3ml Na2SO3溶液恰好将 2 ml 的XO4- 还原,则元素X在还原产物中的化合价为( )A.+1 B.+2 C.+3 D.+4
讨论:8.8 g FeS与400 mL 1ml/L硝酸溶液恰好完全反应,反应后产物为Fe2(SO4)3和Fe(NO3)3、X 、H2O,则X为( )A.N2 B.N2O C.NO D.NO2
2、aFeCl2 + bKNO3+cHCl = dFeCl3 + eKCl + fX +gH2O,其中a、b、c、d、e、f、g均为相应的系数,若b=1,d=3,则生成物X的化学式为( )A、NO2 B、NO C、N2O D、NH4Cl
练习:1、某金属硝酸盐在受热分解时生成了金属氧化物、NO2和O2。其中NO2和O2个数比为4:1。则该金属元素在反应前后的化合价的变化情况是 。(填“升高”“降低”或“不变”)
相关课件
这是一份人教版 (2019)必修 第一册第三节 氧化还原反应优秀课件ppt,共60页。PPT课件主要包含了第三节氧化还原反应,研习一氧化还原反应,自读教材,要点归纳,题组训练等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第三节 氧化还原反应集体备课课件ppt,共12页。PPT课件主要包含了根据电子得失守恒,化合价升降数目相等,配平关键,标变价,电荷守恒,配平下列反应方程式,正向配平法,缺项配平,氧化还原反应的计算,↑6x+2等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教学课件ppt,共29页。PPT课件主要包含了氯化氢形成示意图,表观特征,失氧的反应,有化合价升降的反应,有电子转移的反应,氧化还原反应的定义,化合价,化合价升高,失电子,还原反应等内容,欢迎下载使用。










