




人教版 (2019)必修 第一册第三节 氧化还原反应背景图ppt课件
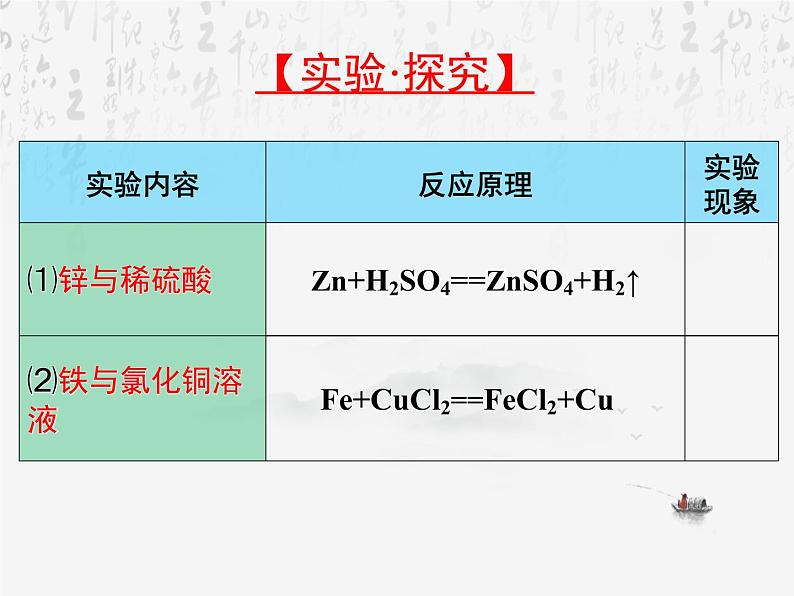
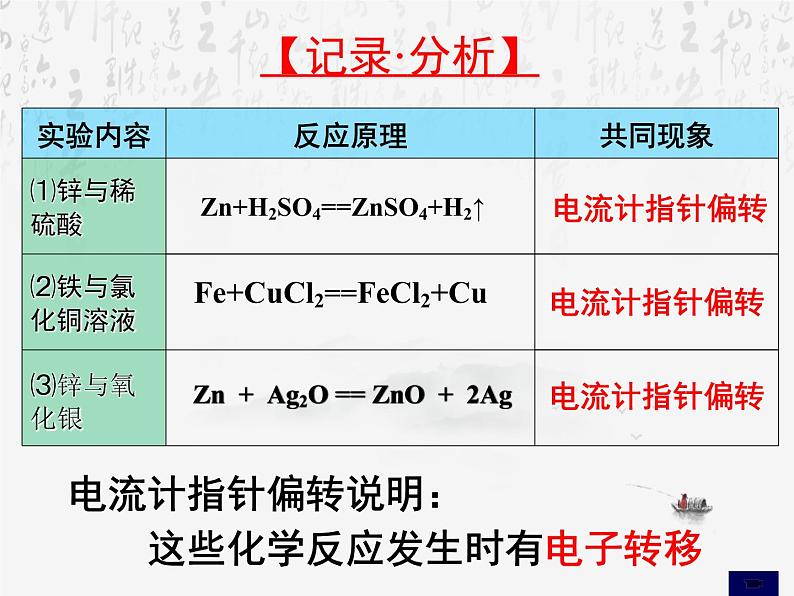
展开Zn + Ag2O == ZnO + 2Ag
有得氧、失氧的化学反应是氧化还原反应
2. 及时记录实验现象
3. 实验结束后请将反应物取出, 并整理实验仪器和药品
1. 各小组确定发言人
电流计指针偏转说明: 这些化学反应发生时有电子转移
0 +1 +2 0
0 +2 +2 0
0 +1 +2 0
元素化合价的变化是氧化还原反应的特征; 电子转移是氧化还原反应的本质
2Na + Cl2 == 2NaCl
元素化合价升高,发生氧化反应
元素化合价降低,发生还原反应
失电子→元素化合价升高→氧化反应得电子→元素化合价降低→还原反应
判断下列反应是否为氧化还原反应,若是,请说出哪种物质发生了氧化反应,哪种物质发生了还原反应
2Fe + 3Cl2 == 2FeCl3
H2O+ CaO == Ca(OH)2
Zn + H2SO4 = ZnSO4 + H2↑
BaCl2 + Na2SO4 = 2NaCl + BaSO4↓
NaCl +AgNO3= NaNO3 + AgCl↓
氧化还原反应与四种基本反应类型的关系可表示为:
思考题:判断下列说法是否正确
⑴有单质参加或生成的反应一定是氧化还 原反应。⑵有单质参加的化合反应一定是氧化还原反应。⑶氧化还原反应过程中,肯定是一种元素被氧化,另一种元素被还原。
2020-2021学年第三节 氧化还原反应课文内容ppt课件: 这是一份2020-2021学年第三节 氧化还原反应课文内容ppt课件,共15页。PPT课件主要包含了炸药爆炸,价态规律,最低价态,化合价升高,还原性,最高价态,化合价降低,氧化性,中间价态,可升也可降等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教学课件ppt,共29页。PPT课件主要包含了氯化氢形成示意图,表观特征,失氧的反应,有化合价升降的反应,有电子转移的反应,氧化还原反应的定义,化合价,化合价升高,失电子,还原反应等内容,欢迎下载使用。
人教版 (2019)必修 第一册第三节 氧化还原反应教课内容ppt课件: 这是一份人教版 (2019)必修 第一册第三节 氧化还原反应教课内容ppt课件,共18页。PPT课件主要包含了知识回顾,得到氧,失去氧,被氧化发生氧化反应,被还原发生还原反应,氧化还原反应,化合价升高,化合价降低,还原反应,氧化反应等内容,欢迎下载使用。













