

第5章初识酸和碱检测题-2021-2022学年九年级化学沪教版(上海)第二学期(word版 含答案)
展开第5章《初识酸和碱》检测题
一、单选题
1.下列物质露置于空气中,因发生化学变化而使质量增加的是
A.浓硫酸 B.烧碱溶液 C.浓盐酸 D.双氧水溶液
2.向20g纯碱和氯化钠的混合物中,加入100g稀盐酸,恰好完全反应后将滤液蒸干,得到固体21.1g,则原混合物中氯化钠的质量分数为
A.37% B.63% C.53% D.47%
3.柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是
A.Mg B.Fe2O3 C.CO2 D.NaOH
4.物质的性质决定其用途。固体氢氧化钠可用作干燥剂,是利用了它的哪种性质( )
A.白色固体B.吸水性C.腐蚀性D.能与空气中的二氧化碳反应
5.硫酸是一种重要的工业原料,下列说法不正确的是
A.浓硫酸可用于干燥O2
B.浓硫酸可使纸张炭化
C.实验室可用块状石灰石与稀硫酸制备CO2
D.稀硫酸可用于金属表面除锈
6.下列描述正确的是( )
A.“H”既可以表示宏观的氢元素,也可以表示微观的一个氢原子
B.烧碱、熟石灰、纯碱按物质分类均属于碱
C.金刚石、均为碳单质,所以物理性质、化学性质完全相同
D.泡沫灭火器灭火的原理是提高了可燃物质的着火点
7.如图是包含物质a、b、c、d和盐酸卡片的“化学拼图”相邻两张卡片所标的物质(或其溶液)间能发生化学反应。单质a不可能是
A.Mg B.Fe C.Ag D.Zn
8.氢氧化钠溶液和氨水都能使酚酞溶液变红,其原因是二者的溶液中均含有一种相同的粒子是
A.H+ B.OH- C.H2O D.H
9.下列有关氢氧化钠性质的说法错误的是( )
A.氢氧化钠有腐蚀性 B.固体氢氧化钠有挥发性
C.氢氧化钠能吸收二氧化碳而变质 D.固体氢氧化钠能吸收水蒸气而潮解
10.下列有关溶液的说法正确的是( )
A.均一、稳定的液体一定是溶液
B.稀释浓硫酸时,会放出大量的热
C.降低温度,不饱和溶液一定能变成饱和溶液
D.实验室利用氯化钠固体和水配制50g质量分数为6%的氯化钠溶液的步骤是:计算、量取、溶解、贮存
11.NaOH可用于造纸和印染工业,NaOH属于
A.单质 B.酸 C.碱 D.盐
12.要使右图装置中的小气球鼓起来,则使用的固体和液体可以是
①硝酸铵和水; ②铁和稀硫酸; ③固体氢氧化钠和水;
④生石灰和水; ⑤石灰石和稀盐酸
A.①②③④⑤ B.②③④⑤
C.②③⑤ D.②④⑤
13.下列溶液在空气中敞口放置后,溶液质量因发生化学反应而减小的是
A.石灰水 B.浓硫酸 C.浓盐酸 D.烧碱溶液
14.下列关于H2SO4性质描述中,不属于酸的通性的是
A.使紫色石蕊溶液变红
B.与NaOH发生中和反应
C.浓硫酸滴到白纸上使纸变黑
D.与Mg反应放出氢气
二、简答题
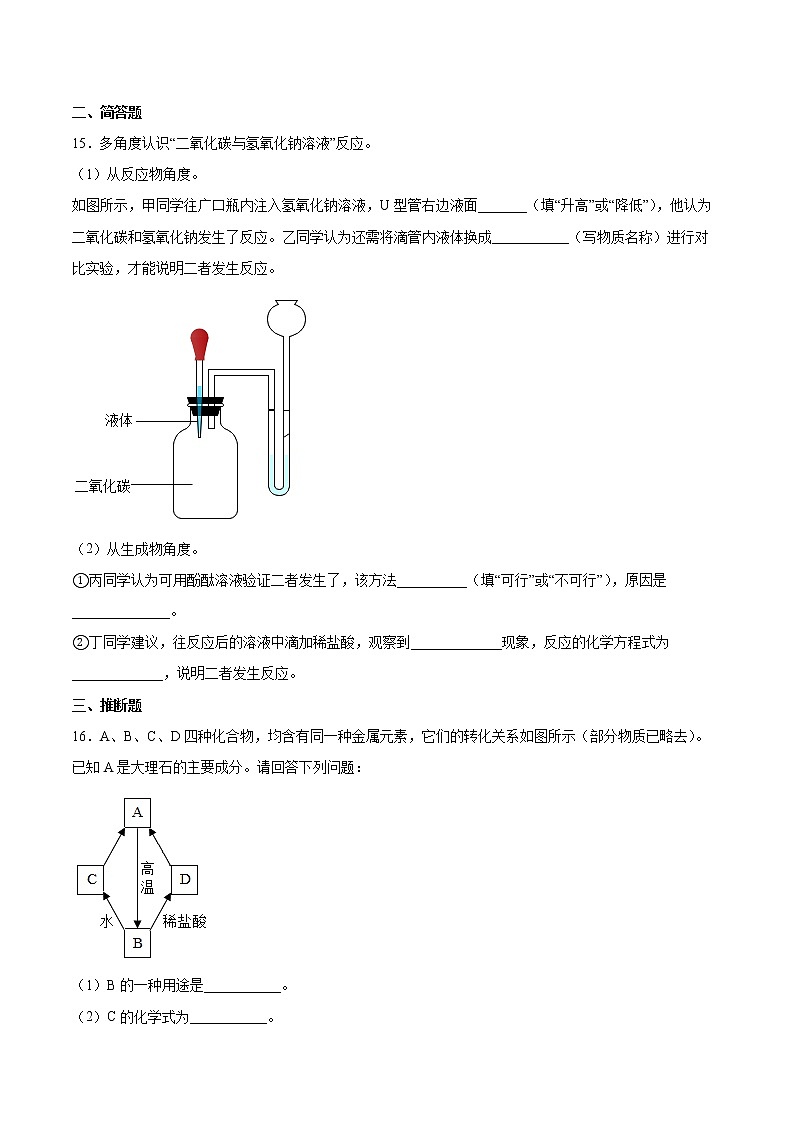
15.多角度认识“二氧化碳与氢氧化钠溶液”反应。
(1)从反应物角度。
如图所示,甲同学往广口瓶内注入氢氧化钠溶液,U型管右边液面_______(填“升高”或“降低”),他认为二氧化碳和氢氧化钠发生了反应。乙同学认为还需将滴管内液体换成___________(写物质名称)进行对比实验,才能说明二者发生反应。
(2)从生成物角度。
①丙同学认为可用酚酞溶液验证二者发生了,该方法__________(填“可行”或“不可行”),原因是______________。
②丁同学建议,往反应后的溶液中滴加稀盐酸,观察到_____________现象,反应的化学方程式为_____________,说明二者发生反应。
三、推断题
16.A、B、C、D四种化合物,均含有同一种金属元素,它们的转化关系如图所示(部分物质已略去)。已知A是大理石的主要成分。请回答下列问题:
(1)B的一种用途是___________。
(2)C的化学式为___________。
(3)B转化为C的反应过程中会_________(填“放热”或“吸热”);C能否通过一步反应转化为D:_______(填“能”或“不能”)。
(4)B转化为D的化学方程式为________________。
17.下图表示元素的化合价与物质类别的关系,“→”表示物质之间可以转化。A、B、C、D、E、F、G是初中化学所学物质,分别由H、O、S、Cl、K、Ba中的一种、两种或三种元素组成。请回答:
(1)A和E的化学式分别为__________和__________。
(2)D与G反应的化学方程式为__________,此反应属__________(填基本反应类型)。
(3)A—G物质间,发生中和反应的化学方程式为__________。
四、实验题
18.甲、乙二个实验用于验证水的性质。
甲:验证水与二氧化碳反应 | 乙:验证水与生石灰反应 |
|
|
①写出甲实验化学反应方程式_________。步骤二,胶头滴管中试剂名称是________。
②乙实验发生反应时出现现象是________。
③甲、乙实验都使用酸碱指示剂,其目的是______________。
19.如图是一套实验室制取气体的装置。请据图回答下列问题:
(1)可用如图制取的气体有 _____ ,写出其中一种的化学反应方程式: _____ 。
(2)若该实验是为了制取干燥的气体,则 B 中应该盛装的药品是 _____ 。
20.某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,同学们提出了如下假设:
假设一:该溶液没有变质 假设二:该溶液部分变质 假设三:该溶液全部变质
请设计实验方案,分别验证以上假设,简要叙述实验步骤和现象____,并写出相关反应的化学方程式____。
五、计算题
21.将适量二氧化碳通入100g氢氧化钠溶液中,恰好完全反应后,得到108.8g碳酸钠溶液。请计算:
(1)参加反应的二氧化碳的质量为_______g;
(2)氢氧化钠溶液的溶质质量分数_________.
22.现有溶质质量分数为20%的NaOH溶液20g,与-定质量的稀盐酸恰好完全反应。
计算:(1)NaOH溶液中溶质的质量为______g
(2)生成NaCl的质量_________。
参考答案:
1.B 2.D 3.C 4.B 5.C 6.A 7.C 8.B 9.B 10.B 11.C 12.B 13.A 14.C
15. 降低 水 不可行 NaOH溶液和Na2CO3溶液都呈碱性,都能使酚酞试液变红色 有气泡产生 Na2CO3+2HCl=2NaCl+H2O+CO2↑
16. 干燥剂 Ca(OH)2 放热 能 CaO+2HCl=CaCl2+H2O
17. SO2 BaO K2SO4+BaCl2=BaSO4+2KCl 复分解 Ba(OH)2+H2SO4=BaSO4+2H2O
18. CO2+H2O=H2CO3 紫色石蕊试液 溶液变红 指示溶液酸碱性,从而证明发生反应生成新物质
19. 氧气或二氧化碳 或 浓硫酸
20. 取少量溶液样品,向溶液的样品中滴加足量氯化钙溶液,若观察到有沉淀出现可判断氢氧化钠已经变质;在反应后的溶液中滴入酚酞,若出现变红则可判断部分变质,因此既出现沉淀又有溶液变红,则溶液部分变质 CaCl2+Na2CO3=CaCO3↓+2NaCl
21.(1)据质量守恒定律可知反应前后物质的总质量不变,参加反应的二氧化碳质量为108.8g-100g=8.8g;
(2)设:溶液中氢氧化钠质量为x。
x=16g
氢氧化钠溶液的溶质质量分数= 。
答:(1)参加反应的二氧化碳的质量为4.4 g;
(2)氢氧化钠溶液的溶质质量分数16% 。
22.(1)4 (2)5.85g










