





初中化学沪教版 (上海)九年级第二学期第六单元 常用的金属和盐6.2 盐和肥料优秀ppt课件
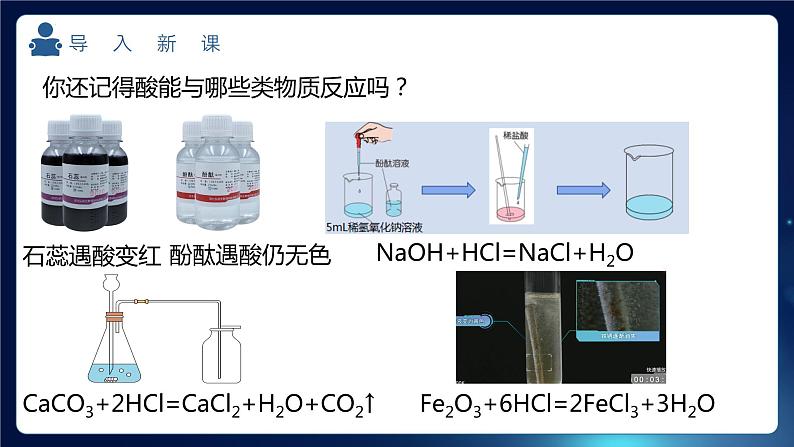
展开你还记得酸能与哪些类物质反应吗?
CaCO3+2HCl=CaCl2+H2O+CO2↑
NaOH+HCl=NaCl+H2O
Fe2O3+6HCl=2FeCl3+3H2O
在这里输入你的详细小段落文本内容,与标题相关并符合整体语言风格,内容简洁,尽量生动在这里输入
硝酸银溶液与稀盐酸的反应
【一、实验目的】硝酸银溶液与稀盐酸的反应【二、实验步骤】1.观察硝酸银溶液的储存方法。2.在盛有少量稀盐酸的试管中滴入几滴硝酸银溶液。观察试管中产生的现象。3.向试管中滴入几滴稀硝酸,观察现象。
3、稀硝酸的作用是什么?为什么要滴加稀硝酸?
Ag2CO3+2HNO3=2AgNO3+CO2↑+H2O
【三、实验现象】生成白色沉淀,加入稀硝酸后沉淀不溶解。
NaCl+AgNO3 = AgCl↓+NaNO3
Na2CO3+ 2AgNO3 = Ag2CO3↓+Na2NO3
1、写出上述反应的化学方程式?
HCl+ AgNO3 = AgCl↓+HNO3
先滴加硝酸银溶液产生白色沉淀, 再加稀硝酸,沉淀不溶解。
硝酸钡溶液、氯化钡溶液分别与稀疏酸的反应
【一、实验目的】探究硝酸钡溶液、氯化钡溶液分别与稀疏酸的反应【二、实验步骤】1.观察硝酸钡、氯化钡溶液的外观。2.在盛有少量稀硫酸的两支试管中,一支滴入几滴硝酸钡溶液,另一支滴入几滴氯化钡溶液。观察现象。3.向试管中滴入几滴稀硝酸,观察现象。
【三、实验现象】两支试管均生成白色沉淀,加入稀硝酸后沉淀不溶解。
Na2CO3+BaCl2 = BaCO3 ↓+ 2NaCl
Na2SO4+BaCl2 = BaSO4↓ + 2 NaCl
H2SO4 +BaCl2 = BaSO4↓ + 2HCl
3、稀盐酸的作用是什么?为什么要滴加稀盐酸?
BaCO3 +2HCl=BaCl2+CO2↑+H2O
2、怎样检验SO42-?
滴加氯化钡溶液产生白色沉淀,再加稀盐酸沉淀不溶解。
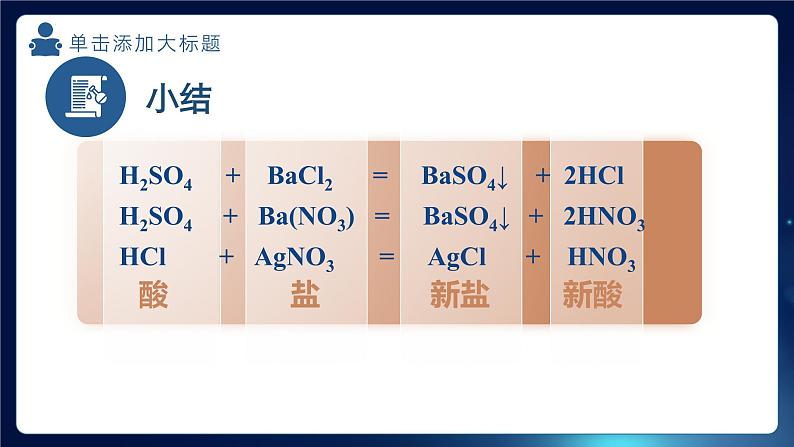
H2SO4 + Ba(NO3) = BaSO4↓ + 2HNO3
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
HCl + AgNO3 = AgCl + HNO3
1.试管内壁上残留的固体物质,不能用稀盐酸除去的是( ) A.盛放过生锈铁钉后留下的红棕色固体 B.用氢气还原氧化铜后留下的红色固体 C.盛放过石灰水后留下的白色固体 D.氢氧化钠溶液与硫酸铜溶液反应后生成的蓝色固体
我们前面学过哪些碱的化学性质了呢?
NaOH+HCl=NaCl+H2O
CO2 + 2NaOH = Na2CO3 + H2O
硫酸铜溶液、硫酸铁溶液分别与与氢氧化钠溶液、澄清石灰水的反应
CuSO4 + Ca(OH)2= Cu(OH)2↓ + CaSO4
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Fe2(SO4)3+ 6NaOH = 2Fe(OH)3↓ + 3Na2SO4
Fe2(SO4)3+3Ca(OH)2= 2Fe(OH)3↓ + 3CaSO4
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Fe2(SO4)3+3Ca(OH)2 = 2Fe(OH)3↓ + 3CaSO4
H2SO4 + Ba(NO3) = BaSO4↓ + 2HNO3
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
HCl + AgNO3 = AgCl + HNO3
思考:从物质的类别角度分析反应物和生成物
由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
特点:“互交换,价不变”。
表达式:AB+CD→AD+CB
复分解反应一般发生在酸、碱、盐和金属氧化物之间,那么是不是酸、碱、盐和金属氧化物之间就一定能发生复分解反应呢?
(1)酸与金属氧化物反应
我们已经学过盐酸和硫酸可以用来除铁锈,请写出化学方程式?
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
这两个反应属不属于复分解反应,有何相同特点?
1.酸+金属氧化物→盐+水
请同学们写出盐酸和氢氧化钙溶液,硫酸和氢氧化钠溶液反应的化学方程式?
酸碱中和反应是否也属于复分解反应?中和反应的生成物中,相同的生成物是什么?
H2SO4+2NaOH==Na2SO4+H2O
2HCl+Ca(OH)2==CaCl2+2H2O
酸 + 碱 → 盐 + 水
请同学们写出碳酸钠、碳酸钙等含碳酸根的盐与盐酸发应的化学方程式?
Na2CO3+2HCl==2NaCl+CO2↑+H2O
CaCO3+2HCl==CaCl2+CO2↑+H2O
酸+碳酸盐→盐+CO2↑+H2O
请写出碳酸钠和氢氧化钙,硫酸铜和氢氧化钠反应的化学方程式
Na2CO3+Ca(OH)2= CaCO3↓+2NaOH
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
BaCl2+CuSO4
CaCl2+Na2CO3
CaCl2+Na2CO3=CaCO3↓+2NaCl
BaCl2+CuSO4= BaSO4↓+CuCl2
请写出氯化钡和硫酸铜,氯化钙和碳酸钠反应的化学方程式?
CaCO3+2HCl=CaCl2+CO2↑+H2O
H2SO4+2NaOH=Na2SO4+H2O
酸+金属氧化物→盐+水
总条件:有沉淀或气体或有水生成
附加条件:反应物均可溶于水
1.判断下列物质间能否发生复分解反应,能的写出化学方程式,不能的 标明“不反应”:(1) HNO3 + Ca(OH)2 — 。(2) BaCO3 + HCl — 。(3) Al2O3 + H2SO4 — 。(4) AgCl + HNO3 — 。(5) KNO3 + NaOH — 。(6) FeCl3 + Ca(OH)2 — 。(7) Na2CO3 + Ba(NO3)2— 。(8) K2CO3 + NH4Cl — 。
Ca(NO3)2 + H2O
BaCl2 + CO2↑ + H2O
Al2(SO4)3 + H2O
Fe(OH) 3 ↓+ CaCl2
BaCO3 ↓+ NaNO3
微观角度看复分解反应发生的实质
HCl+NaOH = NaCl+H2O
H+ + Cl−+Na++OH-=Na++ Cl−+H2O
中和反应的实质:H+ + OH− == H2O
1.盐酸和氢氧化钠溶液反应
旁观离子:Na+,Cl-
HCl=H+ +Cl-
NaOH=Na+ +OH-
2.盐酸和碳酸钠溶液反应
2HCl+Na2CO3=2NaCl+H2O+CO2↑
2H++2Cl-+2Na++CO32- =2Na++2Cl- H2O+CO2↑
反应的本质:2H+ +CO32-=H2O+CO2↑
旁观离子Na+,Cl-
Na2CO3=2Na++CO32-
3.硫酸铜和氢氧化钠溶液反应
CuSO4=Cu2++SO42-
反应的本质:Cu2++2OH-=Cu(OH)2↓
旁观离子:Na+,SO42-
Cu2++SO42-+2Na++2OH-=Cu(OH)2↓+SO42-+2Na+
小结:酸碱盐之间发生的复分解反应的实质是 之间的互换反应,两种离子之间如果能结合成 或放出 或生成难解离的 ,反应就能发生。
如何区分碳酸钠溶液、硫酸钠溶液和氯化钠溶液呢?
一支试管有气体生成,另外两支没有明显变化
一支试管有白色沉淀生成,另外一支没有明显变化
碳酸钠能与稀盐酸反应产生气体,故有气体生成的为碳酸钠溶液
硫酸钠能与氯化钡反应产生白色沉淀,故有白色沉淀生成的为硫酸钠溶液
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2SO4+BaCl2=BaSO4↓+2NaCl
【总结】氯化钡溶液(含稀盐酸或稀硝酸)可用于检验硫酸或可溶性硫酸盐,硝酸银溶液(含稀硝酸)可用于检验盐酸或可溶性盐酸盐。
1.下列反应中不属于复分解反应的是( )A.H2SO4 + Ca(OH)2 = CaSO4 + 2H2OB.H2SO4 + BaCl2 = BaSO4↓ + 2HC1C.2HC1 + Fe = FeCl2 + H2 ↑D.2HC1 + CaCO3 = CaCl2 + CO2 ↑ +H2O
2.下列各组物质中,能相互反应且反应前后溶液总质量保持不变的是( )A.硫酸和烧碱溶液B.铝和硫酸铜溶液C.氧化铁固体和盐酸D.碳酸钾溶液和硝酸钠溶液
3.下列有关复分解反应的说法正确的是( )A.复分解反应不属于基本反应类型B.生成两种化合物的反应一定属于复分解反应C.复分解反应是两种化合物互相交换成分生成另外两种化合物的反应D.中和反应不属于复分解反应
4.对化学反应A+B═C+D的下列说法中不正确的是( )A.若A是稀硫酸,则生成物质中不一定有水B.若C为MgCl2,则A可能为单质、氧化物、碱或盐C.C为盐、D为水,则该反应一定为中和反应D.若A是可溶性碱,B是可溶性盐,则C、D可能是两种沉淀
5.为鉴别失去标签的稀盐酸、稀硫酸、NaOH和Ca(OH)2四种溶液,设计如图实验。下面对试剂①、试剂②和试剂③的选择,合理的是( )
A.①酚酞 ②BaCl2③CuSO4 B.①酚酞 ②AgNO3③Na2CO3C.①石蕊 ②BaCl2③Na2CO3D.①石蕊 ②AgNO3③CuSO4
沪教版 (上海)九年级第二学期6.2 盐和肥料一等奖ppt课件: 这是一份沪教版 (上海)九年级第二学期<a href="/hx/tb_c4006226_t3/?tag_id=26" target="_blank">6.2 盐和肥料一等奖ppt课件</a>,文件包含沪教版化学九年级下册66盐和肥料第1课时课件pptx、五水硫酸铜转化为无水硫酸铜mp4、焰色反应mp4、稀盐酸与硝酸银的反应mp4等4份课件配套教学资源,其中PPT共34页, 欢迎下载使用。
初中沪教版 (上海)6.2 盐和肥料一等奖ppt课件: 这是一份初中沪教版 (上海)6.2 盐和肥料一等奖ppt课件,文件包含62盐和化肥第1课时课件-2023-2024学年九年级化学第二学期同步精品课堂沪教版·上海pptx、3焰色试验mp4、五水硫酸铜转化为无水硫酸铜mp4等3份课件配套教学资源,其中PPT共21页, 欢迎下载使用。
沪教版 (上海)九年级第二学期6.1 奇光异彩的金属优质课课件ppt: 这是一份沪教版 (上海)九年级第二学期6.1 奇光异彩的金属优质课课件ppt,文件包含61奇光异彩的金属第2课时课件-2023-2024学年九年级化学第二学期同步精品课堂沪教版·上海pptx、氢气还原氧化铜mp4、金属与盐酸稀硫酸的反应mp4等3份课件配套教学资源,其中PPT共28页, 欢迎下载使用。













