
第5章初识酸和碱检测题-2021-2022学年九年级化学沪教版(上海)第二学期(word版 含答案)
展开第5章《初识酸和碱》检测题
一、单选题
1.类推是学习化学的一种重要方法,但盲目类推又可能得出错误结论。以下类推正确的是
A.燃烧一般都伴随发光、放热现象,所以有发光放热、放热现象的就是燃烧
B.物质都是由元素组成的,同种元素可以组成纯净物,则不同种元素也可以组成纯净物
C.碱能跟非金属氧化物反应,则碱溶液一定能吸收二氧化碳、二氧化硫、一氧化碳气体
D.原子和分子均是微观粒子,在化学变化中原子不能再分,则分子也不能再分
2.物质的性质决定其用途。下列关于物质用途与性质的说法不正确的是
A.石墨具有导电性,在工业上石墨常用来作电极
B.液态氢气可用作火箭燃料,是因为氢气具有可燃性
C.氧化钙能与水反应,因此氧化钙可作食品干燥剂
D.烧碱和酸能发生中和反应,胃酸过多的病人可以服用烧碱溶液来中和胃中的盐酸
3.推理是化学学习中常用的思维方法,下列推理正确的是
A.生理盐水、酒精溶液是无色透明的,所以溶液都是无色透明的
B.单质是由一种元素组成的,所以由一种元素组成的物质一定是单质
C.酸中一定含有氢元素,则含氢元素的物质一定是酸
D.离子是带电荷的粒子,带电荷的粒子不一定是离子
4.PLA是一种新型可降解塑料,能有效缓解塑料垃圾造成的白色污染。已知PLA由碳、氢、氧三种元素组成,为了测定7.2gPLA样品中氧元素的质量,某化学兴趣小组选用下列装置进行以下探究。
为分别吸收燃烧产物并通过清晰可见的现象检验吸收是否完全,下列说法正确的是
A.实验装置正确的连接顺序是 A→E→B→C→D
B.实验中可以用空气代替纯净氧气
C.正确连接装置后,假设每步均反应并吸收完全,可以根据B、D装置质量变化,求出PLA中氧元素的质量
D.正确连接装置后,假设每步均反应并吸收完全,可以根据 C、E 装置质量变化,求出PLA中氧元素的质量
5.下列四个实验,只发生物理变化的是
A.醋酸除水壶内的水垢 B.提纯混有少量泥沙的氯化钠
C.用灼烧的方法区分羊毛和棉线 D.用石灰水检验人呼出气体中的CO2
6.下列对于宏观现象的微观解释中,错误的是
A.水通电发生分解是因为水分子被破坏形成了新的分子
B.气体受压体积缩小是因为气体中每个分子受压变小了
C.氧气和液氧都能支持燃烧是因为构成它们的分子相同
D.酸具有相似的化学性质是因为酸溶液中都含有氢离子
7.推理是化学研究和学习的重要方法,下列推理合理的是
A.碱性溶液能使酚酞溶液变红,因此能使酚酞溶液变红的溶液一定是碱性溶液
B.中和反应生成盐和水,因此凡是生成盐和水的反应都是中和反应
C.有机化合物都含有碳元素,因此含碳元素的化合物一定是有机化合物
D.某物质能与稀盐酸反应生成气体,则该物质一定是活泼金属
8.规范的实验操作是实验成功的关键,下列实验操作正确的是
A.蒸发食盐水 B.检查气密性
C.稀释浓硫酸 D.加热液体
9.对下列事实的解释错误的是
选项 | 事实 | 解释 |
A | 闻到花香 | 分子不断运动 |
B | 盐酸、硫酸具有相似化学性质 | 都含有相同的氢元素 |
C | 氯化钠溶液导电 | 溶液中含有大量自由移动的钠离子和氯离子 |
D | 空气容易被压缩,水不容易被压缩 | 气体分子之间间隔较大 |
A.A B.B C.C D.D
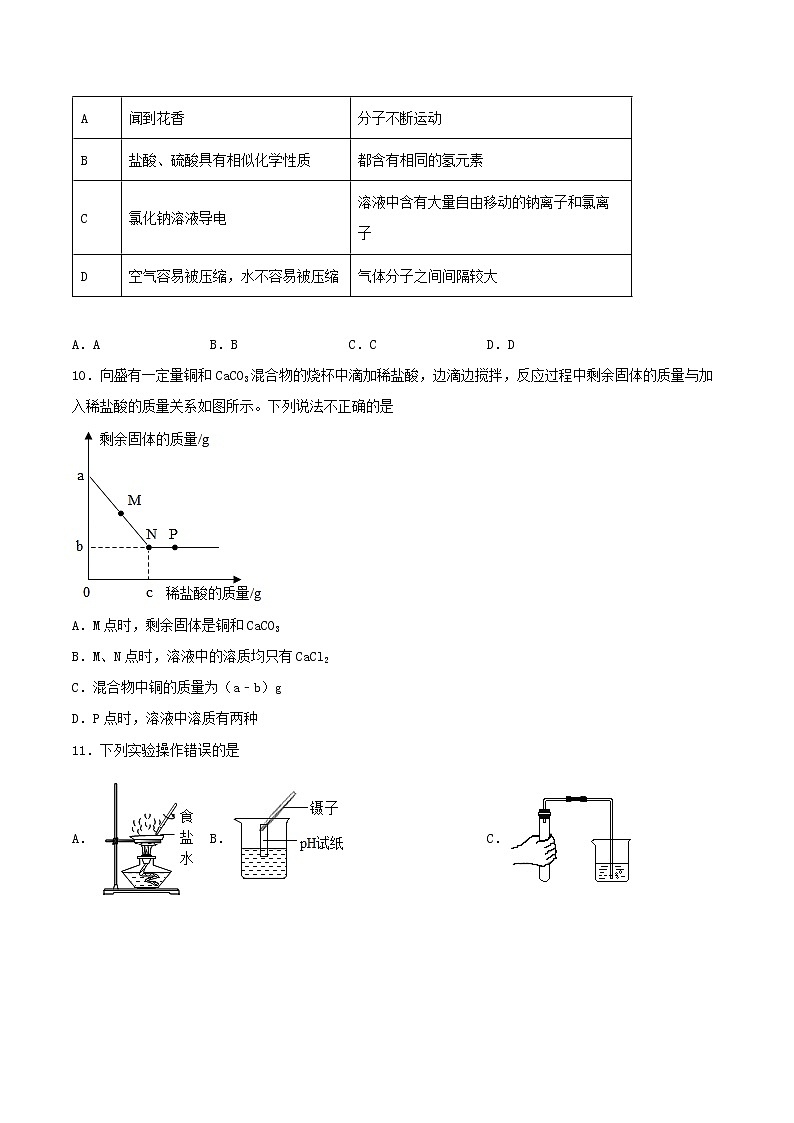
10.向盛有一定量铜和CaCO3混合物的烧杯中滴加稀盐酸,边滴边搅拌,反应过程中剩余固体的质量与加入稀盐酸的质量关系如图所示。下列说法不正确的是
A.M点时,剩余固体是铜和CaCO3
B.M、N点时,溶液中的溶质均只有CaCl2
C.混合物中铜的质量为(a﹣b)g
D.P点时,溶液中溶质有两种
11.下列实验操作错误的是
A. B. C. D.
二、简答题
12.归纳总结是学习化学的一种方法。某同学整理的氢氧化钠的化学性质如图。结合此图回答下列问题:
(1)氢氧化钠能与某些非金属氧化物反应,暴露在空气中易变质,反应的化学方程式为:_____,所以要密封保存。实验室须密封保存的物质还有_____填一种。
(2)写出能与氢氧化钠溶液反应的X中的一种物质的化学式:_____。
(3)写出氢氧化钠溶液与稀硫酸反应的化学方程式_____。
13.我们的家乡是座美丽的滨海小城,海洋蕴含着丰富的资源,以下是人们从海洋中获取某些物质的方法:
①膜法淡化海水获得淡水
②蒸馏法从海水中提取淡水
③向海水中添加石灰乳,再向得到的沉淀中加稀盐酸,然后电解获得的氯化镁制得镁
④开采出原油并进行分馏获得汽油、煤油等产品
⑤用贝壳(主要成分碳酸钙)制石灰乳
(1)请从物质变化的角度对上述方法进行分类:一类是___________(填写序号),另一类是___________(填写序号),你的分类依据是___________。
(2)和①膜法淡化海水原理相同的一个实验操作是________,原理都是依据__________不同将混合物中的各成分分离。
(3)在②蒸馏法淡化海水时水的三态变化过程与自然界中___________循环的原理类似。检验蒸馏法得到水是淡水的化学方法是___________。(用方程式表示)
(4)写出③中电解氯化镁的反应化学方程式___________。
(5)贝壳制得的生石灰可用来做干燥剂,日常生活中常见的干燥剂除了生石灰干燥剂外。还有一种硅胶干燥剂,硅胶吸附性能高、化学性质稳定,其内部为毛孔网状结构,能够吸收水分,并将水分保留住。根据提供的信息分析他们的干燥原理是否相同?___________,理由是____________________。
三、推断题
14.A~F是初中化学常见的6种物质,已知A常用作食品干燥剂,E→F的反应条件是通电。它们之间的反应关系如图所示(部分物质和反应条件已略去),“一”表示相连的物质能相互反应,“→”表示一种物质可生成另一种物质。
(1)A的化学式是_________,F的一种用途是_________。
(2)C→B反应的化学方程式为_________。
(3)D一E反应的化学方程式为_________。
15.A~E是初中化学常见的物质,其中B、C组成元素相同,D、E常温下为气体。图中“—”表示能相互反应,“→”表示转化关系(部分反应物、生成物及反应条件已略去)。根据图示回答下列问题:
(1)D的化学式是____________。
(2)写出图示中C→E的反应方程式:____________。
16.已知A~G均为初中化学常见的物质。B是一种化合物,I能用于改良酸性土壤,F是白色沉淀;A和G,D和E的相关信息(重叠部分表示两种物质的共同点)及它们的相互转化关系如图(图中反应条件均已略去)。请回答下列问题。
(1)写出物质E的化学式:______。
(2)写出反应①的化学方程式:______。该反应______(填“属于”、“不属于”)置换反应。
(3)写出C与I生成F反应方程式______。
四、实验题
17.二氧化碳的制取与性质是初中化学实验的重要内容,根据下图回答问题。
(1)仪器a的名称是_______。
(2)实验室用石灰石与稀盐酸反应制取CO2,应该选择的发生装置是_______(填序号),若用⑤收集CO2则气体应从_______(选填b或c)进。
(3)③中,若X为澄清石灰水,则③中可以观察到的现象是_______,是因为生成_______(填写名称)其形成过程用化学方程式表示为_______。
(4)③中,若X是水,④中能观察到紫色石蕊试纸变红,相关的化学方程式为_______。若④中紫色石蕊试纸没有变红,则X可能是_______(填字号)。
A.NaOH溶液 B.CaCl2溶液 C.浓硫酸 D.稀盐酸
18.下图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),化学小组同学欲利用其进行下列化学实验。试根据题目要求,回答下列问题:
(1)以石灰石和稀盐酸为原料,制备并收集干燥纯净的二氧化碳气体,按照要求设计实验装置,连接仪器,并检验装置的气密性。(提示:盐酸中挥发出的少量 HCl 气体可用饱和碳酸氢钠溶液吸收)
①所选仪器的连接顺序为______(从左到右填写仪器序号字母)。
②上述制取二氧化碳的化学方程式为______。
③若将二氧化碳通入氢氧化钠溶液中,反应后溶液的质量与之前相比会______(填“增大”“减小”“不变”之一)。
(2)随着“限塑令”逐步实施,济南市许多超市已采用可降解塑料袋替代传统塑料袋。化学小组同学以过氧化氢溶液为原料(二氧化锰作催化剂)制取氧气,并对某种塑料试样的组成元素进行分析探究(资料显示该塑料只含 C、H、O 三种元素),所选仪器按“A→B1→E→B2→C→碱石灰干燥管”的顺序连接(B1、B2为浓硫酸洗气瓶),实验前检验装置气密性。使一定质量的塑料试样在氧气中充分燃烧,观察现象,收集有关实验数据(假设发生的化学反应都充分反应)。
①生成氧气时,装置 A 中发生反应的化学方程式为______,检验氧气己收集满的方法是:将带火星的木条放在集气瓶______(填“瓶口“瓶内”之一),若木条______,则证明氧气已收集满。。
②仪器 E 的大玻璃管中放入的塑料试样质量为 5.4g,充分燃烧后,测得仪器 B2的质量增加 3.6g,仪器 C 的质量增加 8.8g,则该塑料试样中氧元素的质量为______g(精确至 0.1g)。
③若装置中没有连接仪器 B1,这样测算出的该塑料试样中氢元素的质量与实际值比较将______(填“偏小”“偏大”“基本一致”之一)。
19.根据下列装置图回答问题:
(1)写出仪器a的名称:a________。
(2)实验室用大理石和稀盐酸制取并收集二氧化碳,应选用的装置为________(填字母),若用F装置干燥二氧化碳气体,F中应加入的试剂是________。
(3)实验室取用药品要注意节约,如果没有说明用量,一般应该取用最少量,固体药品只需盖满试管底部,液体药品取用________mL。
五、计算题
20.希溪同学在实验室里发现了一份含氧化铜的样品10g(杂质不溶于水,不含铜元素,也不与其它物质反应),于是她决定研究其成分质量各是多少进行如图实验。她向样品中先加入100g14.7%的稀硫酸,充分反应后过滤得到108g滤液,再向滤液中加入ag该样品,恰好完全反应,过滤又得到滤液。
(1)写出反应的化学方程式______。
(2)根据知条件列出求解10g样品反应生成硫酸铜质量(X)的比例式为______。
(3)a的质量是______。
(4)向最终所得的滤液中加入88g水,则所得的溶液中溶质的质量分数是______。
(5)用98%的浓硫酸配制实验中用到的稀硫酸,需要加水的质量______。
(6)若将20t上述样品完全反应,能得到含杂质的硫酸铜的质量是______。
21.小明同学想测量某赤铁矿样品中氧化铁的纯度(假设其他成分不和酸反应,也不溶于水),进行如下实验:称取10g赤铁矿样品,加入到烧杯中,再加入92.5g的稀硫酸,恰好完全反应。过滤得滤渣2.5g。试计算:
(1)赤铁矿样品中氧化铁的质量分数?______
(2)求所用稀硫酸的溶质质量分数?_______
参考答案:
1.B 2.D 3.D 4.C 5.B 6.B 7.A 8.C 9.B 10.C 11.B
12. 浓硫酸
13.(1) ①、②、④ ③和⑤ 是否发生化学变化
(2) 过滤 颗粒大小
(3) 水
(4)
(5) 不相同 生石灰干燥是化学变化,硅胶干燥剂干燥过程为物理变化
14.(1) CaO 可以用于医疗急救
(2)(合理即可)
(3)
15. H2
16.(1)O2(合理即可)
(2) (合理即可) 不属于
(3)(合理即可)
17.(1)试管
(2) ② b
(3) 澄清石灰水浑浊 碳酸钙 CO2+Ca(OH)2=H2O+CaCO3↓
(4) H2O+CO2=H2CO3 AC
18.(1) ADBF 增大
(2) 瓶口 复燃 2.6 偏大
19.(1)试管
(2) BD 浓硫酸
(3)1~2
20.(1)
(2)
(3)解:设与10g样品反应的稀硫酸中溶质的质量为y
y=9.8g
则与ag该样品反应的稀硫酸中溶质的质量为:100g×14.7%-9.8g=4.9g;
该样品中氧化铜的质量分数为:;
设再向滤液中加入样品的质量为a
a=5g
答:a的质量为5g
(4)解:设加入5g样品生成硫酸铜的质量为z
z=8g
故所得的溶液中溶质的质量分数是:
(5)解:设需98%的浓硫酸的质量为m,根据稀释前后,溶质的质量不变,可得:100g×14.7%=98%m,m=15g,则需加水的质量为:100g-15g=85g
(6)根据质量守恒定律, 化学反应前后,元素的种类不变,氧化铜中的铜元素完全转化到了硫酸铜中,20t该样品中氧化铜的质量为:20t×80%=16t,杂质的质量为:20t-16t=4t,反应生成硫酸铜的质量为:,则得到含杂质的硫酸铜的质量是:32t+4t=36t
21.(1)
75%
(2)解:设所用稀硫酸的溶质质量分数为x
x=14.9%
答:所用稀硫酸的溶质质量分数为14.9%









