








化学必修 第二册实验活动9 乙醇、乙酸的主要性质集体备课ppt课件
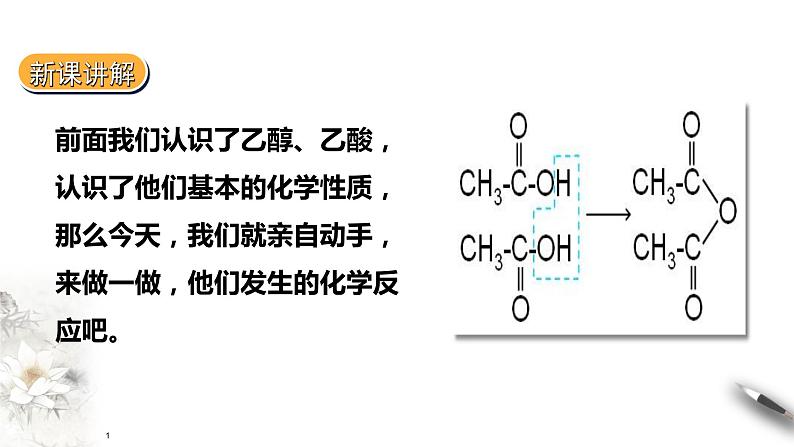
展开前面我们认识了乙醇、乙酸,认识了他们基本的化学性质,那么今天,我们就亲自动手,来做一做,他们发生的化学反应吧。
试管、试管夹、量筒、胶头滴管、乳胶管、橡胶管、铁架台、试管架、酒精灯、火柴、碎瓷片。
乙醇、乙酸、饱和Na2CO3溶液、浓硫酸、铜丝。设计实验的其他用品等。
颜色状态:无色透明的液体气 味:特殊的香味
(1)向试管中加入少量乙醇,观察其状态,闻其气味。
(2)设计实验,验证乙醇的燃烧产物
①在燃烧的酒精火焰上,罩上冷而干燥的烧杯,看到杯壁上出现雾状,这种雾状就是生成的水.马上将烧杯倒置过来,倒入澄清的石灰水,振荡,石灰水变浑浊,说明燃烧的产物是二氧化碳.
乙醇在空气中燃烧 :
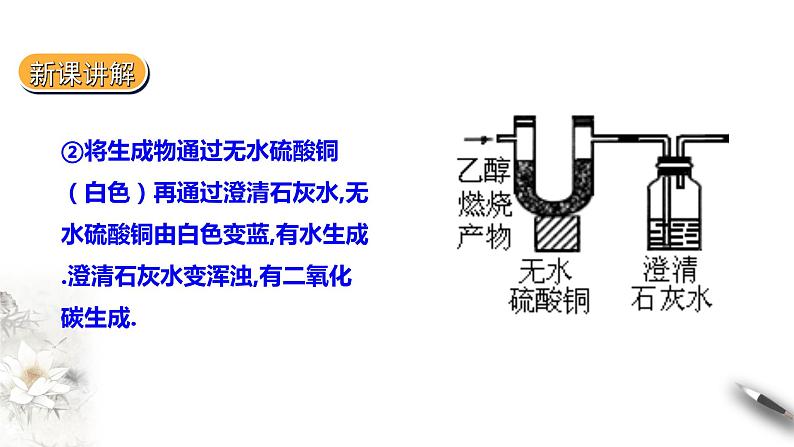
②将生成物通过无水硫酸铜(白色)再通过澄清石灰水,无水硫酸铜由白色变蓝,有水生成.澄清石灰水变浑浊,有二氧化碳生成.
(3)在试管中加入少量乙醇,把一端弯成螺旋状的铜丝放在酒精灯外焰上加热,使铜丝表面生成一薄层黑色的CuO,立即将其插入盛有乙醇的试管中,这样反复操作几次。注意小心地闻生成物的气味,并观察铜丝表面的变化。
a.铜丝红色→黑色→红色反复变化
b.在试管口可以闻到刺激性气味
(1)向试管中加入少量乙酸,观察其状态,小心地闻其气味。
颜色状态:无色液体气 味:有强烈刺激性气味注意:家里的食醋是因为加入了其他物质,导致有颜色。
②和金属反应:Mg + 2CH3COOH ==(CH3COO)2Mg + H2↑
(2)设计实验,证明乙酸具有酸的通性,并比较乙酸与碳酸的酸性强弱。
检验方法:取少量乙酸溶液,滴入两滴紫色石蕊试液,使紫色石蕊试液变红。
检验方法:取一段镁条,插入乙酸溶液,观察有气泡产生,检测是氢气
③和碱反应:NaOH+ CH3COOH ==CH3COONa + H2O
检验方法:取5ml氢氧化钠溶液,加入5ml的醋酸溶液,然后用手感知试管壁的变化,试管壁变热,说明两者发生反应。
④和盐反应:CaCO3+ 2CH3COOH ==(CH3COO)2Ca+H2O+CO2↑
检验方法:取几块石灰石,加入5ml的醋酸溶液,观察是否有气泡产生。
④和金属氧化物:CuO+ 2CH3COOH ==(CH3COO)2Cu + H2O
检验方法:加入氧化铜,观察是否溶解
由反应CaCO3+ 2CH3COOH ==(CH3COO)2Ca + H2O+CO2↑根据强酸制取弱酸的原理,醋酸酸性大于碳酸。
(3)在一支试管中加入2ml乙醇,然后边振荡试管边慢慢加入0.5ml浓硫酸和2ml乙酸,再加入几片碎瓷片。在另一支试管中加入3ml饱和Na2CO3溶液,按图7-22所示连接好装置,用酒精灯小心加热,将产生的蒸气经导管通到饱和Na2CO3溶液的液面上方约0.5cm处,注意观察试管内的变化。取下盛有饱和Na2CO3溶液的试管,并停止加热。振荡盛有饱和Na2CO3溶液的试管,静置,待溶液分层后,观察上层的油状液体,注意闻气味。
【实验现象】饱和碳酸钠溶液的液面上有透明的油状液体,两者分层,并可闻到香味。
酯化反应定义:酸跟醇起作用,生成酯和水的反应实质:酸脱羟基、醇去氢(羟基上的)
酯化反应属于取代反应
1.在乙醇氧化生成乙醛的实验中,加热停四及将它插入乙醇里的操作为什么要反复进行几次。
因为是氧化铜把乙醇氧化为乙醛,而在反应中氧化铜被还原为单质铜,呈红色。反应方程是CH3CH2OH+CuO→CH3CHO+Cu+H2O所以,要想使反应不断进行下去,所以要反复加热铜丝,保证有氧化铜。
2.在制取乙酸乙酯的实验中,浓硫酸和饱和Na2CO3溶液各起什么作用?在实验过程中,盛有饱和Na2CO3溶液的试管内发生了哪些变化?请解释相关现象。
②饱和Na2CO3溶液的作用?
1.中和乙酸;2.溶解乙酸乙酯中乙醇;3.降低乙酸乙酯在水中的溶解度
饱和碳酸钠溶液的液面上有透明的油状液体,并且分层,生成物不溶于水,并可闻到香味。
3.写出实验过程中有关反应的化学方程式。
1.下列试剂中,能用于检验酒精中是否含有水的是 ( )A.CuSO4·5H2O B.CuSO4 C.金属钠 D.浓硫酸
2、炒菜时,加酒加醋可使菜变得味香可口,原因是( ) A. 有盐类物质生成 B. 有酸类物质生成 C. 有醇类物质生成 D. 有酯类物质生成
3、某课外活动小组利用白酒、食醋、蔗糖、淀粉等家庭厨房中常用的物质,进行有趣的化学反应原理验证。利用这些物质不能完成的实验是( )A、检验自来水中是否含氯离子 B、鉴别食盐和碱面C、蛋壳能否溶于酸 D、水壶中的水垢能否溶于酸
4、下列事实能说明碳酸的酸性比乙酸弱的是( )A.乙酸能发生酯化反应,而碳酸不能 B.碳酸和乙酸都能与碱反应C.乙酸易挥发,而碳酸不稳定易分解 D.乙酸和Na2CO3反应可放出CO2
5、质量为a g的铜丝放在空气中灼烧变黑,趁热放入下列物质中,铜丝变红,质量仍为a g的是( )A.CH3COOH B.HNO3 C.CH3CH2OCH3 D.CH3CH2CH2OH
人教版 (2019)必修 第二册实验活动9 乙醇、乙酸的主要性质优秀课件ppt: 这是一份人教版 (2019)必修 第二册实验活动9 乙醇、乙酸的主要性质优秀课件ppt,文件包含新人教版必修2化学76《实验活动9乙醇乙酸的主要性质》课件pptx、76实验活9乙醇乙酸的主要性质教案doc等2份课件配套教学资源,其中PPT共27页, 欢迎下载使用。
高中化学人教版 (2019)必修 第二册第七章 有机化合物实验活动9 乙醇、乙酸的主要性质教学ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第七章 有机化合物实验活动9 乙醇、乙酸的主要性质教学ppt课件,共15页。
高中化学人教版 (2019)必修 第二册实验活动9 乙醇、乙酸的主要性质获奖课件ppt: 这是一份高中化学人教版 (2019)必修 第二册实验活动9 乙醇、乙酸的主要性质获奖课件ppt













