






初中化学沪教版九年级上册第1章 开启化学之门第3节 怎样学习和研究化学课文内容ppt课件
展开1.【中考·攀枝花】现有反应:4A+5B=== 4C+6D,已知C与D的相对分子质量之比为5:3,现将17 g A与一定质量的B恰好完全反应,生成30 g C,则该反应中B与D的质量比为( )A.40:27 B.16:9 C.5:6 D.31:18
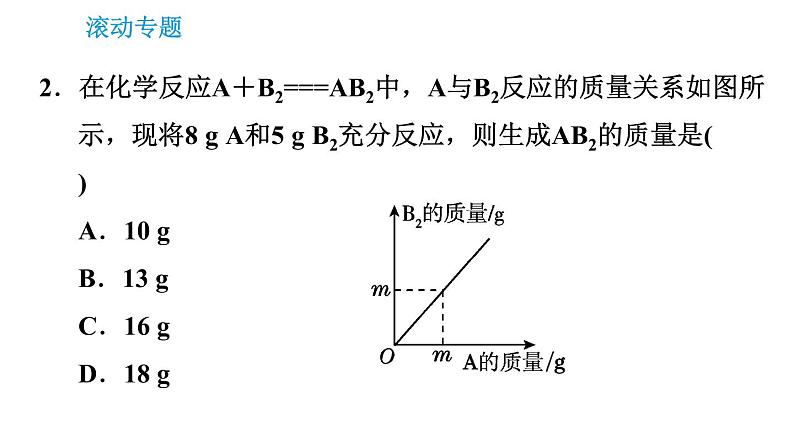
2.在化学反应A+B2===AB2中,A与B2反应的质量关系如图所示,现将8 g A和5 g B2充分反应,则生成AB2的质量是( )A.10 gB.13 gC.16 gD.18 g
【点拨】本题采用图像分析法解答。首先观察图像,反应的A与B2的质量比为1:1,则8 g A与5 g B2反应,A有剩余,5 g B2完全反应,生成AB2的质量为10 g。
3.【中考·枣庄】科学研究中,常通过对实验数据的分析计算,得出某未知物质的相对分子质量,从而推测该物质的分子式。某科研小组经反复实验,发现2A+3B===2C+4D中,3.2 g A恰好和4.8 g B完全反应,生成4.4 g C,请问:(1)同时生成D的质量为________g。
【点拨】生成D的质量为3.2 g+4.8 g-4.4 g=3.6 g。
(2)若D 的相对分子质量为18,求A的相对分子质量(写出计算过程)
4.【2020·德州】“蛟龙号”是我国研制出的大深度载人潜水器。为保证载人潜水器长时间潜水,需要在潜水器里配备供氧装置。过氧化物供氧是一种常见的供氧技术,原理是用过氧化钠(化学式为Na2O2)固体常温下与二氧化碳反应,生成碳酸钠和氧气。若用这种方法制取96 g氧气,则至少需要多少克过氧化钠?(反应的化学方程式为2Na2O2+2CO2===2Na2CO3+O2)
6.【中考·湘西改编】实验室用40 g含碳酸钙75%的石灰石样品与足量的稀盐酸混合制取二氧化碳。求:(1)40 g石灰石样品中含碳酸钙________ g。(2)充分反应后,理论上可制得二氧化碳多少克?(要求:结合化学方程式计算,并写出计算过程)
7.工业上常用煅烧石灰石(主要成分是CaCO3)的方法制取生石灰(CaO)和二氧化碳,现需要制取56 t生石灰,需要含有碳酸钙质量分数为80%的石灰石多少吨?
8.【中考·武汉】实验室有一瓶含杂质的氯酸钾。某兴趣小组利用该药品和二氧化锰制取氧气(杂质不参加反应)。实验数据记录如下:请回答下列问题:(1)a=________。
(2)计算受热分解的氯酸钾的质量(精确到0.1 g)。
9.【2020·鸡西】为测定某种贝壳中碳酸钙的含量,取25 g贝壳,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示(已知杂质不参与反应,也不溶于水)请计算:(1)这种贝壳中碳酸钙的质量分数是________。
(2)25 g贝壳与稀盐酸恰好完全反应时,生成二氧化碳的质量为多少?(写出计算步骤)
答:25 g贝壳与稀盐酸恰好完全反应时,生成二氧化碳的质量是8.8 g。
10.【中考·泰安】厨房中使用的食用碱(主要成分碳酸钠)中往往含有少量的氯化钠,化学兴趣小组的同学通过实验来测定某品牌的食用碱样品中碳酸钠的质量分数。他们实验的过程和数据如图所示。(反应的化学方程式为CaCl2+Na2CO3===CaCO3↓+2NaCl)计算:该食用碱中碳酸钠的质量分数是多少?(计算结果精确至0.1%)
解:生成碳酸钙沉淀的质量为5.0 g,设该食用碱中碳酸钠的质量分数为x。
11.为测定某黄铜(假设合金中仅含铜、锌)中铜的质量分数,兴趣小组同学称取20 g黄铜粉末于烧杯中,将80 g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:(提示:铜与稀硫酸不反应,锌与稀硫酸反应的化学方程式为Zn+H2SO4===ZnSO4+H2↑)
(1)黄铜粉末完全反应生成氢气的总质量为________g。
中考化学复习第24讲有关化学方程式的计算课件: 这是一份中考化学复习第24讲有关化学方程式的计算课件,共60页。PPT课件主要包含了请通过计算回答,答该铁合金是生铁,x=48g,气泡刚好不再产生,请计算,MgO+,FeSO4,x=168g,过氧化氢溶液浓度越,腐蚀性等内容,欢迎下载使用。
中考化学复习专题四有关化学方程式的综合计算课件: 这是一份中考化学复习专题四有关化学方程式的综合计算课件,共47页。PPT课件主要包含了x=325g,y=392g,x=144g,y=36g,6kgz,答案略,H2O,CaCl2,Cu和Fe,请回答相关问题等内容,欢迎下载使用。
初中化学人教版九年级上册课题 3 利用化学方程式的简单计算一等奖课件ppt: 这是一份初中化学人教版九年级上册课题 3 利用化学方程式的简单计算一等奖课件ppt,共22页。PPT课件主要包含了我爱神舟七号,该怎么计算呢,复习回顾,格式和步骤,学案84页找出错误,练一练,解法二,能力提升等内容,欢迎下载使用。













