





初中人教版课题1 生活中常见的盐优秀课件ppt
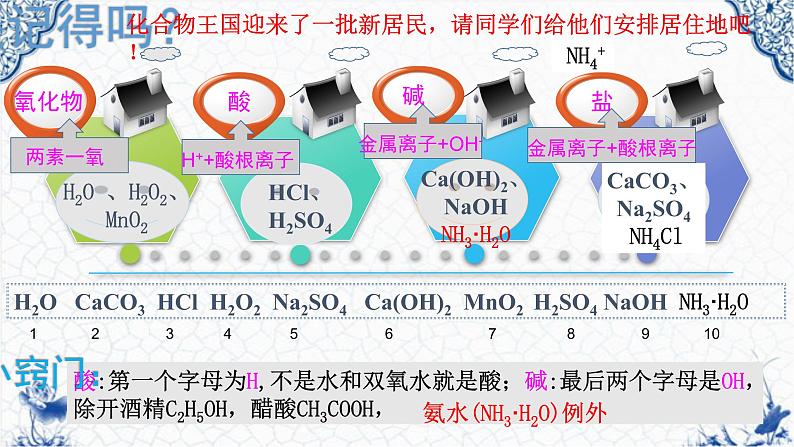
展开化合物王国迎来了一批新居民,请同学们给他们安排居住地吧!
H2O CaCO3 HCl H2O2 Na2SO4 Ca(OH)2 MnO2 H2SO4 NaOH NH3·H2O
酸:第一个字母为H,不是水和双氧水就是酸;碱:最后两个字母是OH,除开酒精C2H5OH,醋酸CH3COOH,
1 2 3 4 5 6 7 8 9 10
氨水(NH3·H2O)例外
原从水中来, 不敢水中行。 人人都要我, 无我食不成。打一物质
交流讨论:“食盐是盐,盐就是食盐”这句话对吗?
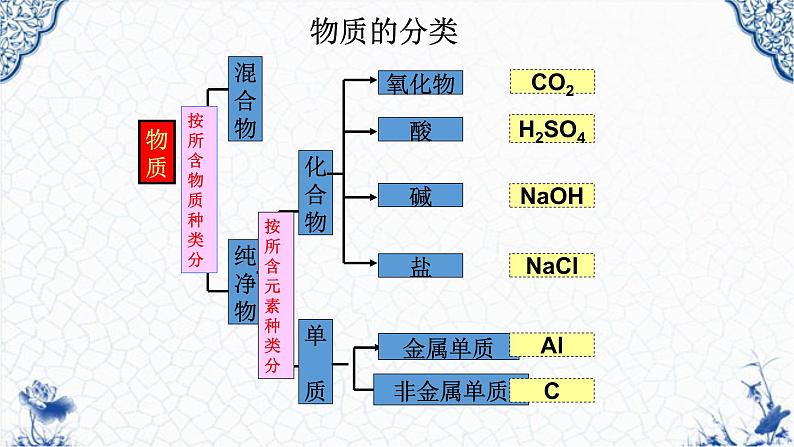
日常生活中所说的盐,通常指食盐(主要成分是NaCl);而化学中的盐不仅仅指食盐,是一类物质。
盐:是指一类组成里含有金属离子(或铵根离子)和酸根离子的化合物。
食盐与我们的生活密不可分,食盐的主要成分是氯化钠,是重要的调味品
亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品,但用量严加限制。
厨师放错盐工人进医院石家庄37人中毒
农户误用某工业盐造成8人食物中毒
科普视频:亚硝酸盐中毒
常见的盐——氯化钠(1)俗称:食盐;(2)化学式:NaCl;(由离子构成)(3)性状:白色晶体,易溶于水,有咸味,溶液呈中性;(4)主要来源:海水、盐湖、盐井、盐矿。
每天每人约需要3--5g左右
钠离子可以维持细胞内外正常水分分布,促进细胞内为物质交换
氯离子参与胃液中胃酸形成
①医疗:用它配制生理盐水:100mL生理盐水含有0.9g氯化钠。 0.9%
②农业:用它的溶液来选种。常需用质量分数为16% 的氯化钠溶液来选种
③工业:以它为原料制取碳酸钠、烧碱、氯气和盐酸等。
④生活中:食盐腌菜,不仅风味独特,还可延长保存时间。
⑤交通上:作融雪剂:除积雪的原理是:在雪中撒食盐,形成了食盐水,其凝固点低于纯水,从而达到除雪的目的。
氯化钠在自然界中的分布
【科普阅读】 海水里含有3%的食盐,氯化钠的溶解度受温度变化影响较小,把海水引进晒盐池,经过风吹日晒、水份蒸发,白花花的食盐就析出来了。其它还有用盐井水,盐湖水熬盐,使食盐溶液达到饱和,再继续蒸发,食盐就成晶体析出,这样制得的盐含有较多杂质,叫做粗盐,粗盐经溶解、沉淀、过滤、蒸发,可制得精盐。 你看到过粗盐在夏天“出汗”吗?这是粗盐里含的杂质(CaCl2,MgCl2)吸收空气里的水分潮解的结果,纯净的食盐是不容易受潮的。
这些美丽的建筑与一种盐有关—碳酸钙(CaCO3)。
二、碳酸钠、碳酸氢钠、碳酸钙的俗名和用途
主要成分是碳酸钙的物质
CaCO3+2HCI=CaCI2+H2O+CO2↑
CO2+Ca(OH)2=CaCO3↓+H2O
碳酸钠(Na2CO3)
水溶液呈碱性,是盐不是碱
用途:常用于玻璃、造纸、纺织和洗涤剂的生产等。
玻璃、纸、纺织品这些物质看起来不相关,它们的生产都要用到一种盐——碳酸钠(Na2CO3)。
碳酸氢钠(NaHCO3)
美味糕点的制作少不了一种盐——碳酸氢钠(NaHCO3)的作用。
建筑材料、补钙剂,实验室制取二氧化碳
三、碳酸钠、碳酸氢钠的化学性质
【实验11-1】碳酸钠、碳酸氢钠分别与盐酸反应,是否都能产生CO2 ?
请同学们写出上述反应的化学方程式:
碳酸钠溶解而减少,产生大量气泡;澄清的石灰水变浑浊。
碳酸氢钠与盐酸反应更加剧烈,迅速产生大量气泡;澄清的石灰水变浑浊。
碳酸钠与盐酸反应,生成二氧化碳气体。
碳酸氢钠与盐酸反应,生成二氧化碳气体。
CaCO3与稀盐酸反应CaCO3+2HCl=CaCl2+H2CO3CO2 ↑+H2OCaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
NaHCO3+HCl= NaCl + H2CO3
Cl+ CO3
2NaCl+H2O+CO2
NaHCO3+HCl=
2NaCl+H2CO3
思考:碳酸钠与盐酸反应实质
Na2CO3+2HCl=
2NaCl+ H2O + CO2↑
Na2CO3 + 2HCl = 2NaCl +
H2O + CO2 ↑
NaHCO3 + HCl = NaCl +
H2O + CO2 ↑
综上所述:含有碳酸根离子(CO32-)或碳酸氢根离子(HCO3-)的盐都能与盐酸反应,产生CO2 气体。
验久置的氢氧化钠是否变质
盐的化学性质1:盐+酸→新盐+新酸
实质:CO32- + 2H+ = H2CO3 + H2CO3=H2O + CO2 ↑
CO32-、HCO3-的检验
取少量样品,加入稀盐酸,将产生的气体通入澄清的石灰水
有气泡产生,气体能使石灰水变浑浊
CO32-、HCO3-
实验探究——碳酸钠溶液与澄清石灰水反应
Na2CO3+Ca(OH)2 == CaCO3↓+2NaOH
碳酸钠与氢氧化钙反应生成碳酸钙,碳酸钙难溶于水,故溶液中出现浑浊(产生白色沉淀)
溶液中出现浑浊(产生白色沉淀)
思考:碳酸钠与氢氧化钙的反应实质:
Na2CO3 + Ca(OH)2=
CaCO3↓ +2NaOH
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
应用: 实验室制取NaOH;(纯碱制烧碱)
除去NaOH中的杂质Na2CO3
盐的化学性质2:盐+碱→新盐+新碱
碳酸钠、碳酸氢钠、碳酸钙
化学式、俗名、物理性质、用途
1.盐溶液可以显中性,如氯化钠溶液;可以显碱性,如碳酸钠、碳酸钾溶液;还可以显酸性。2.除去CO2中的HCl气体:将混合气体通过NaHCO3溶液除去氯化氢气体,再通过浓硫酸干燥。
NaHCO3+HCl=NaCl+CO2↑+H2O
3.氢氧化钠溶液和石灰水的鉴别:①加碳酸钠溶液;②通入CO2气体;③加热(熟石灰的溶解度随温度升高而降低,因此石灰水加热会变浑浊。注:仅是理论上推测)。
NaOHCa(OH)2
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Ca(OH)2+CO2 === CaCO3↓+H2O
2NaOH+CO2=== Na2CO3+H2O
4.石灰水和碳酸钠溶液混合的反应溶质判断:(若为生石灰,则生石灰先与水反应生成熟石灰)三种情况:①氢氧化钙与碳酸钠恰好反应,溶质只有NaOH;②氢氧化钙过量,溶质为NaOH和Ca(OH)2;③碳酸钠过量,溶质为NaOH、Na2CO3。无论哪种情况,溶质都存在NaOH。
人教版九年级下册课题1 生活中常见的盐精品ppt课件: 这是一份人教版九年级下册<a href="/hx/tb_c9873_t3/?tag_id=26" target="_blank">课题1 生活中常见的盐精品ppt课件</a>,共22页。PPT课件主要包含了NaCl,亚硝酸钠,NaNO2,正常的水分,生盐酸HCl,重要的化工原料,盐池盐湖等,蒸发结晶,混合物,过滤蒸发结晶等内容,欢迎下载使用。
人教版九年级下册课题1 生活中常见的盐多媒体教学课件ppt: 这是一份人教版九年级下册课题1 生活中常见的盐多媒体教学课件ppt,共18页。PPT课件主要包含了复习回顾,生活小调查,合作探究1,颜色状态,水溶性,白色固体,小苏打,主要成分,石灰石,合作探究2等内容,欢迎下载使用。
初中化学人教版九年级下册课题1 生活中常见的盐课文ppt课件: 这是一份初中化学人教版九年级下册课题1 生活中常见的盐课文ppt课件,共22页。PPT课件主要包含了洗涤剂,俗称小苏打,发酵粉,治疗胃酸过多,建筑材料,补钙剂,知识回顾,探究实验,稀盐酸,澄清石灰水等内容,欢迎下载使用。













