

























人教版九年级下册课题1 生活中常见的盐教学演示课件ppt
展开【重点】知道复分解反应发生的条件。
【难点】判断复分解反应能否发生。
1.知道复分解反应的概念及特点;2.根据复分解反应发生的条件,判断酸、碱、盐之间的反应能否发生;3.知道酸、碱、盐的溶解性。
请同学们思考下面三个反应与我们前面所学的化合、分解、置换三种反应有什么不同?
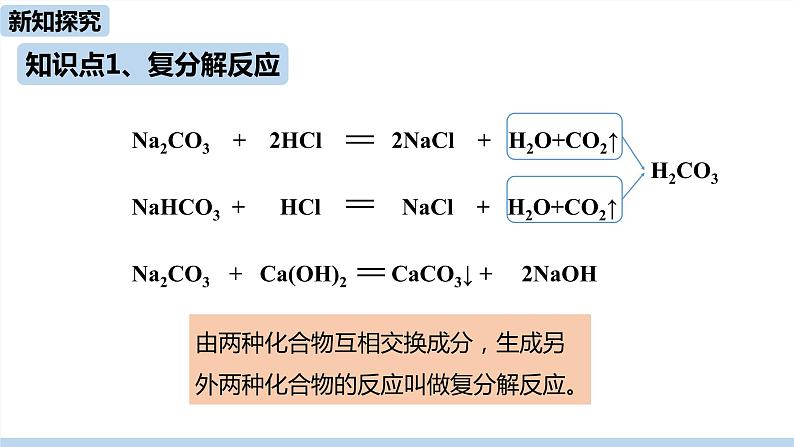
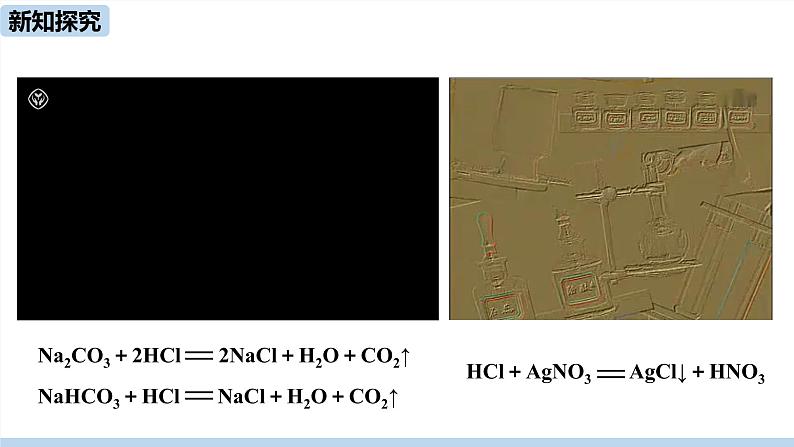
Na2CO3+2HCl 2NaCl+H2O+CO2↑NaHCO3+HCl NaCl+H2O+CO2↑Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
Na2CO3 + 2HCl 2NaCl + H2O+CO2↑NaHCO3 + HCl NaCl + H2O+CO2↑Na2CO3 + Ca(OH)2 CaCO3↓ + 2NaOH
由两种化合物互相交换成分,生成另外两种化合物的反应叫做复分解反应。
特点:“互交换,价不变”。表达式:AB+CD→AD+CB。(正价在前,负价在后)
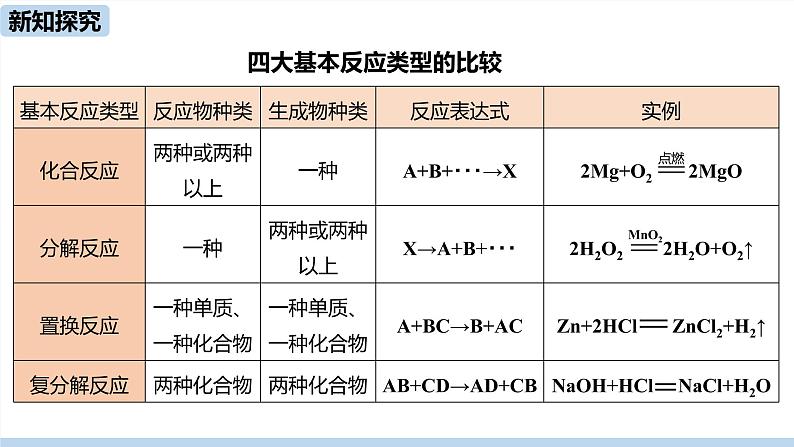
四大基本反应类型的特点
四大基本反应类型的比较
下列化学反应属于复分解反应的是( )A. Zn+H2SO4 ZnSO4+H2↑B. 2KMnO4 K2MnO4+MnO2+O2↑ C. CaO+H2O Ca(OH)2 D. CuSO4+2NaOH Cu(OH)2↓+Na2SO4
思考:复分解反应的反应物和生成物均为化合物,但是两种化合物反应生成另两种化合物的反应不一定是复分解反应,什么条件下复分解反应才能发生呢?
复分解反应发生的条件—实验探究
CuSO4 + 2NaOH Cu(OH)2↓+Na2SO4
CuSO4 + BaCl2 BaSO4↓+ CuCl2
1.上述两个反应是否属于复分解反应?实验现象有什么共同之处?
2.前面学过的酸碱中和反应是否也属于复分解反应?中和反应的生成物中,相同的生成物是什么?
3. 含碳酸根的盐溶液与盐酸发生复分解反应时,可观察到的共同现象是什么?
酸、碱、盐之间并不是都能发生复分解反应。只有当两种化合物互相交换成分,生成物中有沉淀、气体或水时,复分解反应才能发生。
1.常见的酸大多溶于水;2.常见的碱中只有五种溶于水:KOH、NaOH、Ba(OH)2、Ca(OH)2、NH3·H2O;3.钾盐、钠盐、铵盐、硝酸盐,都能溶于水;
4.盐酸盐(也称氯化物)不溶于水的有AgCl;5.硫酸盐不溶于水的有BaSO4;6.碳酸盐:含钾、钠、铵根离子的碳酸盐溶于水。
酸类易溶除硅酸;碱溶钾、钠、铵和钡;钾、钠、铵盐、硝酸盐,都能溶在水中间;盐酸盐不溶银;硫酸盐不溶钡;碳酸盐很简单,能溶只有钾、钠、铵。
部分酸、碱、盐的溶解性口诀
根据复分解反应发生的条件,并利用有关酸、碱、盐溶解性信息,判断硫酸与下表中的四种化合物的溶液之间是否能发生复分解反应。
酸、碱、盐之间发生复分解反应的具体条件
复分解反应的实质是两种化合物在水溶液中互相交换离子,只要离子之间能够互相结合生成气体、沉淀或水,反应就可以发生。
Ca(OH)2 + Na2CO3 ——
2NaOH+ CaCO3↓
(2019·重庆模拟)下列各组物质中,能发生复分解反应且反应后溶液总质量变小的是( )
A.铁和硫酸铜溶液 B.氢氧化钠溶液和盐酸C.稀硫酸和氯化钡溶液 D.碳酸钠溶液和氯化钾溶液
复分解反应发生的条件:生成物中有气体、沉淀或水
定义:由两种化合物互相交换成分,生成另外两种化合物的反应
1.下列关于复分解反应的说法正确的是( )A.反应物必须都溶于水B.反应物中一定有酸C.生成物中一定有盐D.中和反应一定不属于复分解反应
2.下列各组物质的溶液之间能发生复分解反应,且有沉淀生成的是( )A.H2SO4、Na2CO3 B.NaCl、KNO3C.NaOH、HCl D.FeCl3、NaOH
3.(2020·德州)下列物质间能够发生反应,但没有出现明显现象的是( ) A.将稀盐酸滴入盛石灰石的试管中 B.将CO2通入NaOH溶液中 C.将碳酸钠溶液滴入澄清石灰水中 D.将稀硫酸滴入NaCl溶液中
【点拨】将CO2通入NaOH溶液中,反应生成碳酸钠和水,能发生反应,但无明显现象,故B选项符合题意。
4.(2020·临沂)将下列各组物质放入足量的水中,充分搅拌后,得到无色溶液的是( ) A.硝酸钾和氯化铁 B.氢氧化钾和盐酸 C.硫酸铜和氢氧化钠 D.硫酸钠和氯化钡
【点拨】氯化铁溶液显黄色,A不正确;氢氧化钾和盐酸反应生成氯化钾和水,充分搅拌后,得到无色溶液,B正确;硫酸铜溶液和氢氧化钠溶液反应生成氢氧化铜沉淀和硫酸钠,C不正确;硫酸钠溶液和氯化钡溶液反应生成硫酸钡沉淀和氯化钠,D不正确。
5.向盛有少量碳酸钠溶液的试管中滴入澄清石灰水,对其中发生的反应的说法错误的是( )A.反应会产生白色沉淀B.化学方程式为Ca(OH)2+Na2CO3 CaCO3+2NaOHC.两种化合物互相交换成分生成另两种化合物D.属于复分解反应
解析:在溶液中进行的反应,生成的碳酸钙是沉淀,应该加上沉淀符号。
6.写出下列复分解反应的化学方程式。①氢氧化钾溶液和稀硫酸反应:___________________________________。②碳酸钾溶液和稀盐酸反应:_______________________________________。③硫酸铜溶液和氢氧化钙溶液反应:____________________________________。④碳酸钠溶液和氯化钙溶液反应:______________________________________。
2KOH+H2SO4 K2SO4+2H2O
K2CO3+2HCl 2KCl+H2O+CO2↑
CuSO4+Ca(OH)2 Cu(OH)2 ↓+CaSO4
Na2CO3+CaCl2 CaCO3↓+2NaCl
7.判断复分解反应是否发生,不必考虑的是( )A.是否有水生成 B.是否有气体生成C.是否有沉淀生成 D.金属活动性顺序
解析:判断复分解反应是否发生,需考虑是否有水、气体或沉淀生成。根据金属活动性顺序主要是判断金属与酸或盐溶液能否反应。
8.某校化学兴趣小组的同学学习了酸、碱、盐的知识后,对课本中“酸、碱、盐之间并不是都能发生复分解反应”这句话产生了兴趣,展开了探究性学习。(1)【提出问题】发生复分解反应应具备哪些条件?(2)【活动探究】该小组同学进行以下四组实验,发现均能反应,写出反应④的化学方程式:______________________________________。①硝酸钡溶液与稀硫酸 ②稀硫酸与碳酸钾溶液③稀盐酸与氢氧化钠溶液 ④硝酸钡溶液与碳酸钾
Ba(NO3)2+K2CO3===BaCO3↓+2KNO3
(3)【理论分析】上述反应为什么能够发生?是因为在这些反应物的溶液中有特殊的阴、阳离子,它们两两结合生成了沉淀、气体或水。如:①中有Ba2+SO42-===BaSO4↓;②中有2H++CO32-===H2O+CO2↑;③中有H++OH-===H2O;④中有____________________两种离子,所以才发生化学反应。
(4)【得出结论】经过分析,该小组同学得出以下结论:生成物中是否有______、______或______生成,是判断酸、碱、盐之间能否发生复分解反应的主要条件。(5)【形成网络】按照一定的顺序排列某些离子,可以形成知识网络。用“——”相连接的阴、阳离子间能两两结合生成沉淀、气体或水。现有Ca2+、HCO3-两种离子,请将它们填入下面合适的“ ”内,使其形成一个更为完整的复分解反应的知识网络。
人教版九年级下册课题1 生活中常见的盐精品ppt课件: 这是一份人教版九年级下册<a href="/hx/tb_c9873_t3/?tag_id=26" target="_blank">课题1 生活中常见的盐精品ppt课件</a>,共22页。PPT课件主要包含了NaCl,亚硝酸钠,NaNO2,正常的水分,生盐酸HCl,重要的化工原料,盐池盐湖等,蒸发结晶,混合物,过滤蒸发结晶等内容,欢迎下载使用。
人教版九年级下册课题1 生活中常见的盐教学课件ppt: 这是一份人教版九年级下册课题1 生活中常见的盐教学课件ppt,共11页。PPT课件主要包含了通过这节课的学习,我还想学习,我体会到了,我收获了等内容,欢迎下载使用。
人教版九年级下册课题1 生活中常见的盐多媒体教学课件ppt: 这是一份人教版九年级下册课题1 生活中常见的盐多媒体教学课件ppt,共18页。PPT课件主要包含了复习回顾,生活小调查,合作探究1,颜色状态,水溶性,白色固体,小苏打,主要成分,石灰石,合作探究2等内容,欢迎下载使用。












