初中化学沪教版九年级下册第3节 物质的溶解性课后练习题
展开1下列有关溶液的说法错误的是( )
A.碘酒中的溶剂是酒精
B.改变条件,饱和溶液与不饱和溶液可以相互转化
C.氢氧化钙的饱和溶液一定是浓溶液
D.析出晶体后的溶液是该温度下的饱和溶液
2下列说法正确的是( )
A.浓溶液一定比稀溶液的质量分数大
B.不饱和溶液转化为饱和溶液后,质量分数一定增大
C.同种物质的饱和溶液一定比它的不饱和溶液要浓
D.在一定温度下,同种物质的饱和溶液总要比其不饱和溶液要浓
3室温下,向200 g硝酸钾溶液中加入20 g硝酸钾固体,充分搅拌后,尚有2 g固体未溶解,再加入20 mL水后,固体全部溶解。下列说法正确的是 …( )
A.原溶液是饱和溶液
B.加入固体搅拌后得到的是饱和溶液
C.加水后得到的一定是饱和溶液
D.加水后得到的一定是不饱和溶液
4要使一杯氯化铵不饱和溶液变为饱和溶液,可采取的方法是( )
A.加水 B.不断搅拌
C.升高温度 D.加氯化铵晶体
5现有60 ℃的饱和NaCl溶液,与该溶液有关的量有:①水的质量;②溶液中溶质NaCl的质量;③NaCl的质量分数;④溶液的质量。用序号填空:
(1)将该饱和溶液稀释,不变的量有________________________________________________________________________;
(2)将该饱和溶液降温至20 ℃,一定变化的量有
________________________________________________________________________。
6已知硝酸钾的溶解度随温度升高而增大。请将硝酸钾的不饱和溶液与饱和溶液相互转化的方法填写在括号中。(每个过程填写一种方法即可)
我综合 我发展
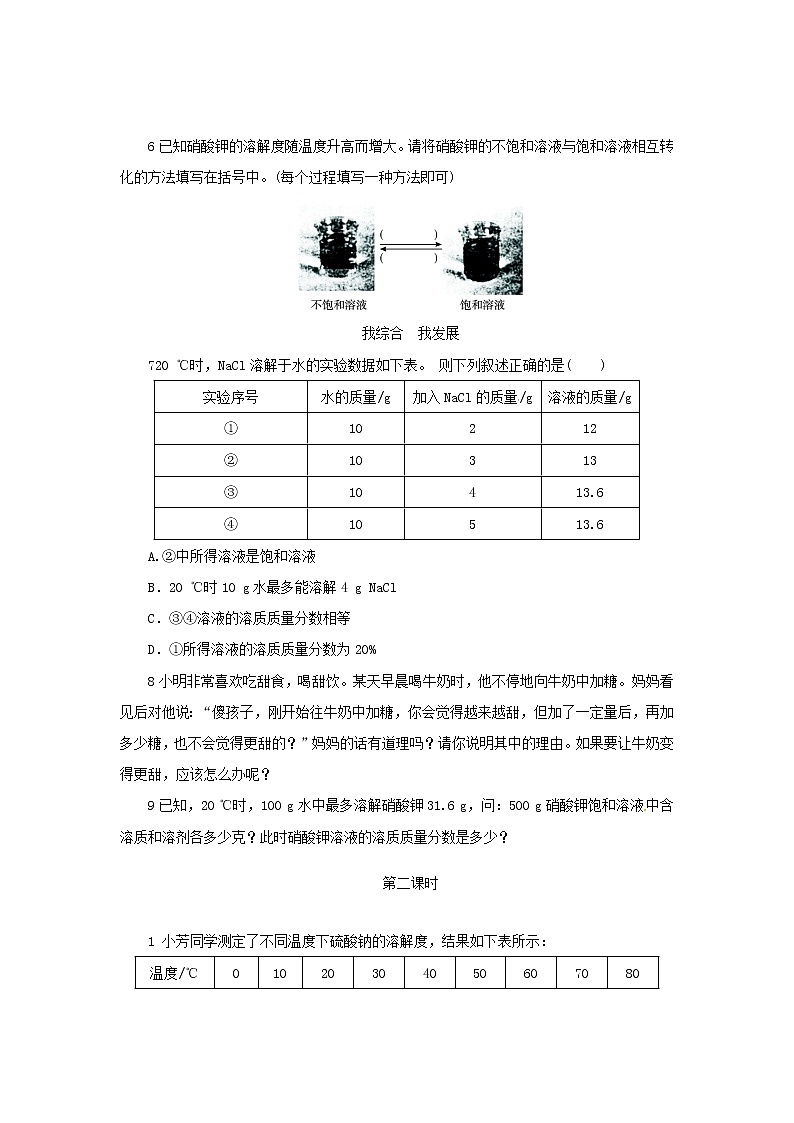
720 ℃时,NaCl溶解于水的实验数据如下表。 则下列叙述正确的是( )
A.②中所得溶液是饱和溶液
B.20 ℃时10 g水最多能溶解4 g NaCl
C.③④溶液的溶质质量分数相等
D.①所得溶液的溶质质量分数为20%
8小明非常喜欢吃甜食,喝甜饮。某天早晨喝牛奶时,他不停地向牛奶中加糖。妈妈看见后对他说:“傻孩子,刚开始往牛奶中加糖,你会觉得越来越甜,但加了一定量后,再加多少糖,也不会觉得更甜的?”妈妈的话有道理吗?请你说明其中的理由。如果要让牛奶变得更甜,应该怎么办呢?
9已知,20 ℃时,100 g水中最多溶解硝酸钾31.6 g,问:500 g硝酸钾饱和溶液中含溶质和溶剂各多少克?此时硝酸钾溶液的溶质质量分数是多少?
第二课时
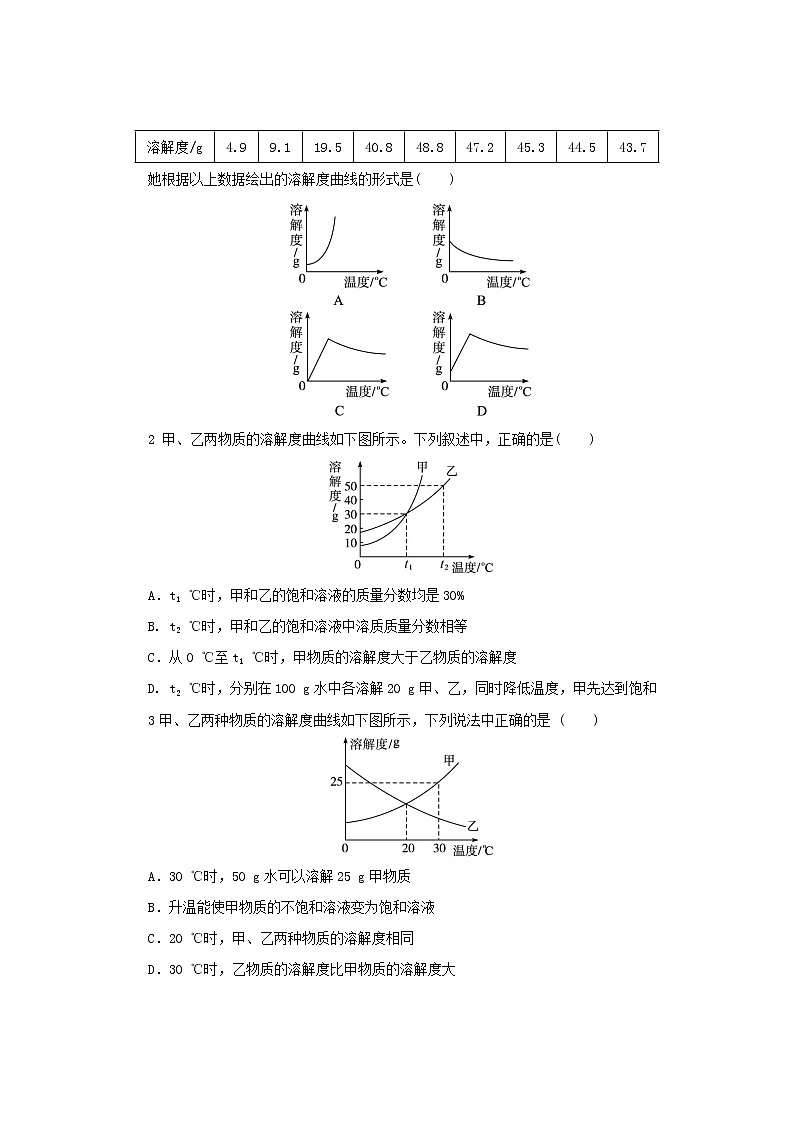
1 小芳同学测定了不同温度下硫酸钠的溶解度,结果如下表所示:
她根据以上数据绘出的溶解度曲线的形式是( )
2 甲、乙两物质的溶解度曲线如下图所示。下列叙述中,正确的是( )
A.t1 ℃时,甲和乙的饱和溶液的质量分数均是30%
B. t2 ℃时,甲和乙的饱和溶液中溶质质量分数相等
C.从0 ℃至t1 ℃时,甲物质的溶解度大于乙物质的溶解度
D. t2 ℃时,分别在100 g水中各溶解20 g甲、乙,同时降低温度,甲先达到饱和
3甲、乙两种物质的溶解度曲线如下图所示,下列说法中正确的是 ( )
A.30 ℃时,50 g水可以溶解25 g甲物质
B.升温能使甲物质的不饱和溶液变为饱和溶液
C.20 ℃时,甲、乙两种物质的溶解度相同
D.30 ℃时,乙物质的溶解度比甲物质的溶解度大
4根据下图熟石灰的溶解度曲线,以下说法正确的是( )
A.熟石灰的溶解度为0.165 g
B.熟石灰的溶解度随温度升高而增大
C.熟石灰的饱和溶液降温时会析出晶体
D.20 ℃时,100 g水中加入1 g熟石灰,搅拌,得到饱和溶液
5 下图是A、B两物质的溶解度曲线,下列说法正确的是( )
A.A、B两种物质的溶解度都随温度升高而增大
B.降低温度可使接近饱和的B溶液变为饱和
C.A、B两种物质的溶解度均为25 g
D.t2 ℃时,A物质的溶解度大于B物质的溶解度
6 下表是不同温度时KNO3的溶解度数值,根据此表回答下列问题。
(1) KNO3的溶解度随温度的变化趋势是________________________________________________________________________。
(2) KNO3的溶解度为50 g时的温度范围是________________________________________________________________________。
(3)请在下边画出KNO3的溶解度曲线
我综合 我发展
7下图是甲、乙两固体物质的溶解度随温度变化的曲线图,据此回答下列问题:
(1)40 ℃时,甲物质溶解度为________ g。
(2)溶解度随温度变化影响比较大的物质是________。
(3)30 ℃时,向100 g水中加入30 g乙物质,充分溶解后,所得溶液是________溶液(填“饱和”或“不饱和”),所得溶液中溶质的质量分数为________。
8 下图是根据NaCl、KNO3两种物质的溶解度绘制的溶解度曲线。
(1)根据图表信息可知,图中b表示________的溶解度曲线。
(2)t1 ℃时,a物质的饱和溶液中溶质的质量分数________b物质的饱和溶液中溶质的质量分数(填“大于”“小于”或“等于”)。
第三课时
1 提纯含有泥沙的粗盐,其操作步骤为( )
A.溶解、蒸发、过滤、结晶
B.溶解、过滤、蒸发、结晶
C.溶解、结晶、蒸发、过滤
D.蒸发、过滤、溶解、结晶
2现将40 ℃时的一杯硝酸钾溶液降温至20 ℃,结果有少量晶体析出,则下列说法错误的是( )
A.40 ℃时的溶液一定为饱和溶液
B.20 ℃时溶液中溶质的质量分数比40 ℃时小
C.20 ℃时的溶液一定为饱和溶液
D.溶剂的质量没有改变
3下列关于溶液的说法错误的是( )
A.饱和溶液析出晶体后,其溶质的质量分数可能不变
B.在溶液里进行的化学反应,通常比较快
C.同种溶质的饱和溶液,一定比它的不饱和溶液的溶质质量分数大
D.不饱和溶液转化为饱和溶液,溶质质量分数可能不变
4下图为A、B、C三种物质的溶解度曲线,请据图判断下列叙述中不正确的是( )
A.t1 ℃时,B物质的溶解度为40 g
B.t2 ℃时,三种物质的溶解度由大到小的顺序为:A>B>C
C.要将C的不饱和溶液转化为饱和溶液可以采取降温的方法
D.要使A从其浓溶液中析出,可采用冷却热饱和溶液法
5图1是a、b两种物质的溶解度曲线。室温时,将盛有a、b饱和溶液的试管分别放入烧杯内的水中,均无晶体析出。当向烧杯内的水中加入硝酸铵固体或浓硫酸后,图2试管内所示现象正确的是( )
图1
图2
6 将NH4Cl与少量NaCl的混合溶液降温,NH4Cl晶体大量析出,而NaCl却仍留在了溶液中。根据下图的溶解度曲线,你认为NH4Cl先结晶的原因可能是什么?
__________________________________________________。
我综合 我发展
7 下图中M、N表示两种固体物质(不含结晶水)的溶解度曲线,试根据图中曲线判断下列说法正确的是( )
A.图中A点表示M、N两种物质在t1 ℃时均达到饱和
B.M、N两种饱和溶液,当温度从t1降至t2时,一定析出相同质量的晶体
C.同处A点的相同质量的M、N两种溶液,当温度从t1降至t2后,剩余溶液的质量分数相等
D.0 ℃时,M、N具有相同的溶解度
8 A、B两种物质的溶解度曲线如下图。则:
在t2 ℃时,物质的溶解度B________A (填:“大于”“小于”或“等于”);当B溶液中含有少量A时,可用________法提纯B;在t2 ℃时,一定量的A物质的饱和溶液蒸发掉10 g水,可得到m g A晶体(不含结晶水),那么该温度时A的溶解度为________g。
9 某化学兴趣小组的同学想要绘制硝酸钾、食盐、氢氧化钙的溶解度曲线。用实验方法测定得到这三种物质在不同温度下在水中的溶解度数值,并记录如下:(表:硝酸钾、氯化钠、氢氧化钙在不同温度时的溶解度)
(1)请你在方框内画出硝酸钾、氯化钠、氢氧化钙的溶解度曲线。
(2)从表格或图像上分析:分离氯化钠和硝酸钾应采用的方法是________;用此方法时,配制氯化钠和硝酸钾混合溶液的最佳温度为______;分离时的最佳温度为______(从表格中选择数据填写)。在降温过程中,大量析出的物质是______,为了提高晶体的纯度,应将过滤出的晶体用________(选填“热”或“冷”)水进一步洗涤干净。
(3)要把氢氧化钙的不饱和溶液转变成饱和溶液,可采取的方法有__________、____________和________________。
参考答案
1解析:氢氧化钙是微溶于水的物质,它的饱和溶液相对于其他物质(如氯化钠的饱和溶液)而言,在同一温度下属于稀溶液。
答案:C
2解析:对同种溶质来说,在同一温度下,浓溶液一定比稀溶液的质量分数大,故A错。若是通过改变温度且没有溶质析出,不饱和溶液转化为饱和溶液时溶质的质量分数不变,故B错误。C项的说法没有指明是在同一温度下,故错误。
答案:D
3解析:“加入20 g硝酸钾固体,充分搅拌后,尚有2 g固体未溶解”,这说明原溶液是不饱和溶液,而硝酸钾溶解且剩余2 g后所得溶液则是饱和溶液。加水后未溶解的硝酸钾全部溶解,无法说明此时的溶液是否已经达到饱和状态。
答案:B
4解析:氯化铵的溶解度随温度的升高而增大,因此,使一杯氯化铵不饱和溶液变为饱和溶液,则可以采用增加溶质、降低温度等方法。
答案:D
5解析:(1)稀释溶液时,溶质质量不变;(2)将饱和氯化钠溶液降温有氯化钠晶体析出,则溶液中的氯化钠质量减少,溶液质量也随之减少,温度改变则溶解度改变,溶质的质量分数减小。
答案:(1)② (2)②③④
6答案:加硝酸钾固体(或加溶质或蒸发水或降低温度或蒸发溶剂) 加水(或加溶剂或升高温度或加硝酸钾的不饱和溶液)
7解析:由②③可以看出,②中形成的溶液并不是饱和溶液,而是氯化钠的不饱和溶液,故A错。根据③④来看,在20 ℃时10 g水最多能溶解3.6 g NaCl,而不是4 g,故B错。同时③④形成的溶液是20 ℃时的饱和溶液,因此,③④溶液中的溶质质量分数相等,故C正确。由于在①中氯化钠全部溶解,因此形成的溶液中溶质的质量分数为2 g/12 g×100%=16.7%,因此D是错误的。
答案:C
8答案:因为牛奶中溶解的糖达到饱和后,就不能再继续溶解了,如果要让牛奶变得更甜,可以升高牛奶的温度。
9答案:120.1 g、379.9 g、24%
第二课时
1解析:由题给数据可知,在0~40 ℃时,硫酸钠的溶解度随温度的升高而增大,但自40 ℃时,溶解度随温度的升高而减小,但是减小的幅度很小;再是在0 ℃时,硫酸钠的溶解度并不为零。
答案:D
2解析:t1℃时,甲和乙两物质的饱和溶液中的溶质质量分数是30 g/(100+30) g×100%=23.1%,故A错误;t2 ℃时,甲和乙两物质的溶解度并不相同,因此在该温度下两物质的饱和溶液中溶质的质量分数并不相等,故B错误;由图示可知,从0 ℃至t1 ℃时,甲物质的溶解度小于乙物质的溶解度,故C错误;甲物质的溶解度受温度的影响较大,因此二者同时降温,甲物质先达到饱和。
答案:D
3解析:由图示可知,30 ℃时,甲物质的溶解度是25 g,因此,在该温度下50 g水中最多能溶解12.5 g的甲物质,故A错误。甲物质的溶解度随温度的升高而增大,因此可以采用降低温度的方法使其变为饱和溶液,故B错误。在20 ℃时,甲、乙两物质的溶解度曲线相交,因此在该温度下二者的溶解度相同,故C正确。在30 ℃时,甲物质的溶解度大于乙物质的溶解度,因此D错误。
答案:C
4解析:A选项并没有说明温度,不符合要求,因此A错误;由图示可知,熟石灰的溶解度随温度的升高而减小,因此B错误;降低温度,熟石灰的饱和溶液会转变为不饱和溶液,因此不会有晶体析出,故C错误。
答案:D
5解析:由图示可知,B物质的溶解度随温度的升高而减小,因此A错误;降低温度会使B物质的饱和溶液变成不饱和溶液,因此B错误;t1 ℃时,A、B物质的溶解度相同,在其他温度却没有相交的点,因此C是错误的。
答案:D
6答案:(1)溶解度随温度升高而增大 (2)20~40 ℃ (3)略
7解析:从甲、乙物质的溶解度曲线可知,甲的溶解度随温度的升高而明显增大,乙物质的溶解度随温度变化不大,并且30 ℃时,乙的溶解度为25 g,那么此时向100 g水中加入30 g乙物质,所得溶液是饱和溶液,其溶质的质量分数为25 g/125 g×100%=20%。
答案:(1)35 (2)甲 (3)饱和 20%
8解析:氯化钠的溶解度受温度的影响较小,而硝酸钾的溶解度受温度的影响较大,因此b是氯化钠的溶解度曲线;在t1 ℃时,a物质的溶解度与b物质的溶解度相同,因此该温度下的两种物质的饱和溶液中溶质的质量分数相等。
答案:(1)NaCl (2)等于
第三课时
1答案:B
2解析:溶液有高温降低到低温,有晶体析出,并不能说明原溶液是饱和溶液。
答案:A
3解析:同种溶质的饱和溶液并不一定比它的不饱和溶液浓,例如20 ℃的硝酸钾饱和溶液与80 ℃接近饱和的硝酸钾不饱和溶液。因此正确的说法应是在同一温度下,同一种溶质的饱和溶液一定比它的不饱和溶液要浓。
答案:C
4解析:C物质的溶解度随温度的升高而减小,因此若要使C物质的不饱和溶液转变为饱和溶液可采用升高温度的方法,故C错误。
答案:C
5解析:a物质溶解度曲线随温度的升高而增大,因此其饱和溶液若降低温度则有晶体析出(硝酸铵溶解吸热,浓硫酸稀释放热)。
答案:A
6答案:NH4Cl溶解度受温度影响较大,而NaCl溶解度受温度影响不大
7解析:在A点表示M物质的溶液是饱和状态,但N物质的溶液是不饱和状态,故A错;由图示可知,M、N两种饱和溶液,当温度从t1降至t2时,N物质析出的质量最多,故B错误;在t2 ℃时,M、N两物质的溶解度相同,因此,其饱和溶液中溶质的质量分数相同,故C正确;在0 ℃时,M的溶解度大于N物质的溶解度,故D错误。
答案:C
8解析:在t2 ℃时,A物质的溶解度大于B物质的溶解度;由于B物质的溶解度受温度的影响不大,因此可采用蒸发溶剂的方法来提纯;由题意可知,t2 ℃时10 g水最多溶解m g A物质,因此,在该温度下,A物质的溶解度是10m g。
答案:小于 蒸发溶剂 10m
9答案:(1) (图略)
(2)冷却热饱和溶液(降温结晶) 50 ℃ 0 ℃ KNO3 冷
(3)加一定量的Ca(OH)2 升温 恒温蒸发掉一些水分实验序号
水的质量/g
加入NaCl的质量/g
溶液的质量/g
①
10
2
12
②
10
3
13
③
10
4
13.6
④
10
5
13.6
温度/℃
0
10
20
30
40
50
60
70
80
溶解度/g
4.9
9.1
19.5
40.8
48.8
47.2
45.3
44.5
43.7
温度/℃
0
20
40
60
80
溶解度/g
13.3
31.6
63.9
110
169
温度( ℃)
0
10
20
30
40
50
硝酸钾(克)
13.3
31.6
37.7
48.8
63.9
92.5
氯化钠(克)
35.7
35.8
36.0
36.3
36.5
36.8
氢氧化钙(克)
0.19
0.18
0.17
0.16
0.14
0.12
初中沪教版第6章 溶解现象第3节 物质的溶解性课时作业: 这是一份初中沪教版<a href="/hx/tb_c9823_t7/?tag_id=28" target="_blank">第6章 溶解现象第3节 物质的溶解性课时作业</a>,共13页。试卷主要包含了选择题,判断题,综合应用题等内容,欢迎下载使用。
化学九年级下册第3节 物质的溶解性习题: 这是一份化学九年级下册第3节 物质的溶解性习题,共15页。试卷主要包含了选择题,判断题,科学探究题,综合应用题等内容,欢迎下载使用。
沪教版九年级下册第3节 物质的溶解性精练: 这是一份沪教版九年级下册第3节 物质的溶解性精练,共10页。试卷主要包含了单选题,判断题,填空题,综合应用题等内容,欢迎下载使用。