




2021学年第二节 水的电离和溶液的酸碱性课文ppt课件
展开1、溶液导电性强弱是由 ________________________决定的。
溶液中自由移动离子浓度
2、水是不是电解质?
研究电解质溶液时往往涉及溶液的酸碱性,而酸碱性与水的电离有密切的关系。那么水是如何电离的呢?
实验测定:25℃ C(H+)=C(OH-)=1×10-7ml/L 100℃ C(H+) = C(OH-) = 1×10-6ml/L
既然一定温度下纯水中C(H+)和C(OH-)浓度是定值,那么乘积呢?
Kw =C(H+)·C(OH-)
说明:1.常温(25℃ )Kw = 1× 10-14 2.稀溶液 3.温度升高, Kw变大
2、水的离子积(常数):
定义:在一定温度下,水(稀溶液)中H+与OH-浓度的乘积,用Kw表示。
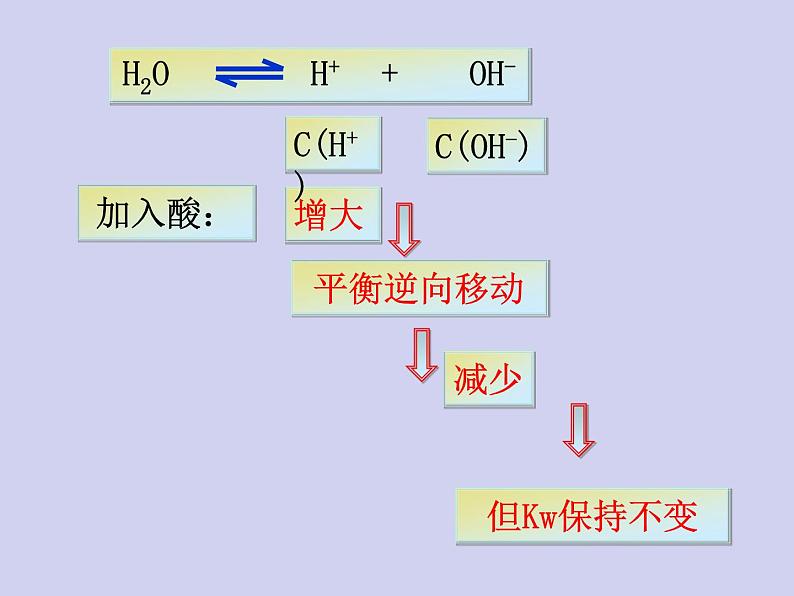
1、在水中加入强酸(HCl)后,水的离子积是否发生改变?
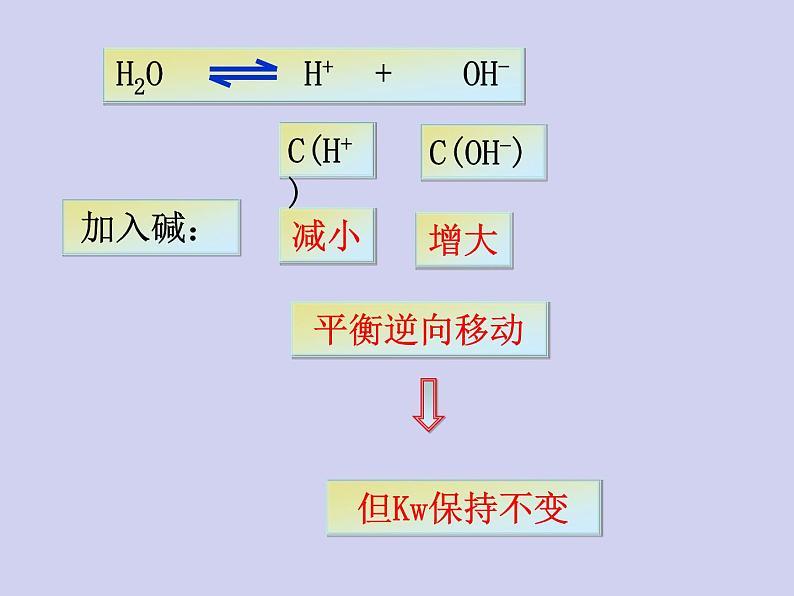
2、在水中加入强碱(NaOH)后,水的离子积是否发生改变?升温呢?
3、在酸碱溶液中,水电离出来的C(H+)和C(OH-)是否相等?
4、100℃时,水的离子积为10-12,求C(H+)为多少?
5、在酸溶液中水电离出来的C(H+)和酸电离出来的C(H+)什么关系?
C(H+)和C(OH-)都增大
二、影响水的电离平衡的因素
抑制水的电离,Kw保持不变
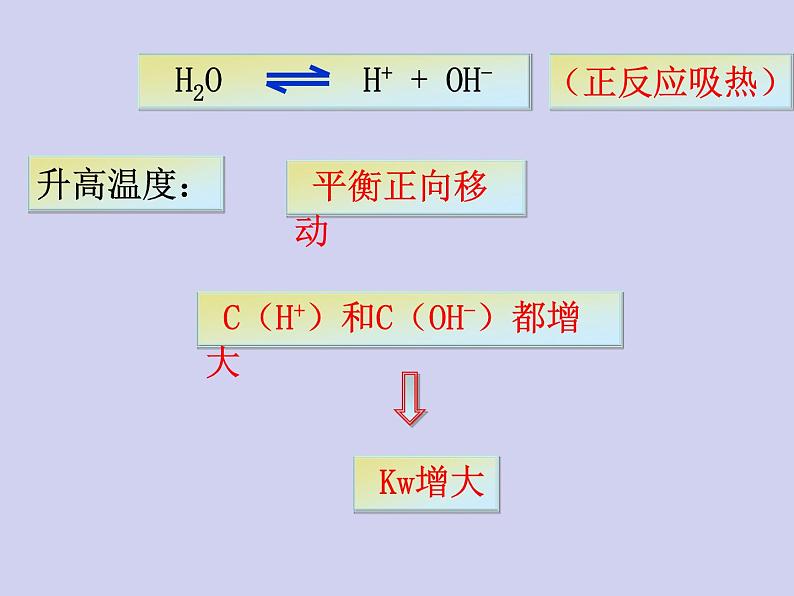
升高温度促进水的电离,Kw增大
注意:Kw是一个温度函数,只随温度的升高而增大.
三、溶液的酸、碱性跟C(H+)、C(OH-)的关系
在一定温度时,稀电解质溶液里C(H+)与C(OH-)的乘积是一个常数。
C(稀) ≤1ml/L
例:25℃时,Kw=1×10-14 100℃时,Kw=1×10-12
①水溶液中H+与OH-始终共存
②酸性溶液:C(H+)>C(OH-) ;C(H+)越大酸性越强
③碱性溶液:C(H+)
C(H+)>C(OH-) C(H+)>1×10-7ml/L
C(H+)
例1:计算下列溶液中C(H+)与C(OH-)
(1)1×10-3ml/LHCl溶液
(2)0.05ml/LBa(OH)2溶液
由Kw = C(H+)· C(OH-),得
C(HCl)=1×10-3 ml/L
1×10-11 ml/l
1×10-3 ml/l
例2:10mL10-4ml/LHCl,加水至100mL,此时溶液中 C(H+)= ml/L;若加水至105mL,此时溶液中 C(H+)又是
接近10-7ml/L,略大于10-7ml/L
①酸的溶液中C(H+),以酸所电离出的H+浓度为准,若酸过度稀释,C(H+)接近10-7ml/L,但略大于10-7ml/L ②碱的溶液中C(OH-),以碱所电离出的OH-浓度为准,若碱过度稀释,(OH-)接近10-7ml/L,但略大于10-7ml/L
(2)常温下,浓度为1×10-5ml/l的NaOH溶液中,由水电离产生的C(OH-)是多少?
练习1.(1)常温下,浓度为1×10-5ml/l的盐酸溶液中,由水电离产生的C(H+)是多少?
(1)解:C水(H+)=C水(OH-)
= 1×10-9 ml/l
1×10-5 ml/l
(2)解:C水(OH-)= C水(H+)
思考题:在常温下,由水电离产生的C(H+)=1×10-9 ml/L的溶液,则该溶液的酸碱性如何?
答:可能是酸性也可能是碱性
C、NaHSO4
A、NaOH
(2)常温下,某溶液中由水电离产生的C(H+)=10-9 ml/l,则此溶液有可能是( )
2.(1)常温下,某溶液中由水电离产生的 C(H+)=10-6 ml/l,则此溶液有可能是( )
1、纯水在10℃和50℃的H+浓度,前者与后者的关系是( )
2、下列微粒中不能破坏水的电离平衡的是( ) A、H+ B、OH- C、S2- D、Na+
3、下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是( )
4、某温度下纯水中C(H+) = 2×10-7 ml/L,则此时溶液中的C(OH-) = ___________。若温度不变,滴入稀盐酸使C(H+) = 5×10-6 ml/L,则此时溶液中的C(OH-) = ___________。
2×10-7 ml/L
8×10-9 ml/L
5、在常温下,0.1ml/L的盐酸溶液中水电离出的C(H+ )和C(OH-)是多少?
6、在常温下, 0.1ml/L的NaOH溶液中水电离出的C(H+)和C(OH-)是多少?
水电离出的C(OH-)=1×10-14/0.1=1×10-13ml/L = C(H+ )
7、在25 ℃,在某无色溶液中由水电离出的C(OH-)= 1×10-13,一定能大量共存的离子组是( )NH4+ K+ NO3- Cl-NO3- CO3 2 - K+ Na+ K+ Na+ Cl- SO42-Mg2+ Cu2+ SO42- Cl-
8、根据水的电离平衡H2OH++OH- 和下列条件的改变,填空:
← ↑ ↓ —→ ↓ ↑ —— — — —→ ↑ ↑ ↑
9、水的电离过程为H2O H+ + OH-,在不同温度下其离子积为KW25℃=1×10-14, KW35℃ =2.1 ×10-14。则下列叙述正确的是:A、[H+] 随着温度的升高而降低B、在35℃时,纯水中 [H+] >[OH-]C、水的电离常数K25 >K35D、水的电离是一个吸热过程
11、 25℃、浓度均为0.1ml/L的下列溶液中[H+]由大到小的排列顺序:①氨水 ②NaOH ③盐酸 ④醋酸
10、判断正误:任何水溶液中都存在水的电离平衡。 任何水溶液中(不论酸、碱或中性) ,都存在Kw=10-14 。 某温度下,某液体[H+]= 10-7ml/L,则该溶液一定是纯水。
③ 〉④ 〉① 〉②
第二节 水的电离和溶液的酸碱性
(2)水的电离是可逆的,存在电离平衡,它的逆反应为中和反应
结论(1)水是极弱的电解质,它能微弱“自身”电离生成H+与OH-
A、水的电离过程是吸热,升高温度, Kw将增大
25℃时,Kw=c(H+)·c(OH-) =1×10-14
B、水的离子积不仅适用纯水,也适用于酸、碱、盐的稀溶液
Kw=c(H+)·c(OH-)
2、水的离子积常数Kw
(1)定义:在一定温度下,水中c(H+)和c(OH-)的乘积是一个常数,用Kw表示 ,叫做水的离子积常数。
A、酸、碱:温度不变,在纯水中加入酸或碱,均使水的电离左移 , Kw不变 ,α(H2O) 变小
在纯水中加入能水解的盐,不管水解后显什么性,均促进水的电离,但只要温度不变, Kw不变。
如:向水中加入活泼金属
二、溶液的酸碱性与pH值
1、定义:化学上常采用H+的物质的量浓度的负对数来表示溶液的酸碱性。
3、溶液的酸碱性与pH值的关系
酸性溶液: c(H+)>c(OH—) pH<7中性溶液: c(H+)=c(OH—) pH=7碱性溶液: c(H+)
2、表示方法:pH= - lg c(H+)
注意:pOH -----采用OH -的物质的量浓度的负对数来表示溶液的酸碱性 pOH + pH ==14
注意:pH=0 并非无H+,而是c(H+)=1ml/L,
pH=14 并非无OH -,而是c(OH -)=1ml/L
2、强酸、强碱的稀释:
例1、0.001 ml/L盐酸的pH =____,加水稀释到原来的10倍,pH=___,加水到原来的103倍,pH =___,加水到原来的104 倍pH= _____,加水到原来的106倍,pH=______
例2、pH=10的NaOH溶液加水稀释到原来的10倍,则溶液的pH=_____,pH=10的NaOH溶液加水稀释到原来的102倍,则溶液的pH=_______
pH=10的NaOH溶液加水稀释到原来的103倍,则溶液的pH=___,pH=10的NaOH溶液加水稀释到原来的105倍,则溶液的pH=___
注意:pH=6或8时,不可忽略水的电离,只能接近7,酸碱溶液无限稀释,pH只能约等于7或接近7:酸不能大于7;碱不能小于7
结论:强酸(碱)每稀释10倍,pH值向7靠拢一个单位。
3、弱酸、弱碱的稀释例3、pH=3HAc加水稀释到原来10倍,溶液的pH值范围_________;pH=12氨水加水稀释到原来10倍,溶液的pH值范围___________。
结论:弱酸(碱)每稀释10倍,pH值向7靠拢不到一个单位;
4、两种pH值不同的同种强酸(碱)溶液等体积混合
例4、pH=10和pH=8的两种NaOH溶液等体积混合,求混合溶液的pH值。
例5、pH=4和pH=5的两种盐酸溶液等体积混合,求混合溶液的pH值
结论: 1、两种强酸溶液等体积混合,溶液的pH值等于浓溶液的pH加0.3。
总结论: 两种强酸(碱)溶液等体积混合,溶液的pH值以原浓溶液的pH向7靠拢0.3个单位。
2、两种强碱溶液等体积混合,溶液的pH值等于浓溶液的pH减0.3。
例8、0.1L pH=2盐酸和0.1L pH=11的NaOH溶液相混合,求混合后溶液的pH值。 例9、pH=2盐酸和pH=12的Ba(OH)2溶液等体积相混合,求混合后溶液的pH值。
5、强酸、强碱溶液的混合
结论:1、pH1+ pH2<14的强酸强碱等体积混合后,pH混= pH酸+0.32、pH1+ pH2=14的强酸强碱等体积混合后,pH混= 73、pH1+ pH2>14的强酸强碱等体积混合后,pH混= pH碱-0.3
方法:1、先反应2、按过量的计算,若酸过量,求c(H+),再算pH值。 若碱过量,求c(OH-),求c(H+),再算pH值
五、弱酸强碱或强酸弱碱混合例10、(1)PH为12 的NaOH溶液和PH为2的醋酸溶液等体积相混合,则混合液呈_____性(2)PH为12 的氨水和PH为2 的盐酸等体积相混合,则混合液呈 ____性(3)PH为2 的盐酸和PH为12 的某碱等体积相混合,则混合液PH_______ (4)PH为12 的NaOH溶液和PH为2的某酸溶液等体积相混合,则混合液PH _____(5)盐酸的PH值为X,NaOH溶液的PH为Y,体积相混合,则混合液PH _____
己知X+Y=14,它们等体积相混合,混合液的PH值 。己知X+Y<14,它们等体积相混合,混合液的PH值 ____________。己知X+Y>14,它们等体积相混合,混合液的PH值 ____________。
(5)盐酸的PH值为X,NaOH溶液的PH为Y,体积相混合,则混合液PH _____
1、某酸溶液的PH为2 ,某碱溶液的PH为12 ,两者等体积相混合后,有关PH值的变化正确的是( ) A、大于7 B、小于7 C、等于7 D、三种都有可能
2、常温下一种PH为2 的酸溶液与一种PH为12 的碱溶液等体积相混合,对溶液的酸碱性的说法正确的是( ) A、 若是二元强酸和一元强碱,混合液为酸性 B、 若是浓的强酸和稀的强碱,混合液中呈酸性 C、 若是浓的弱酸和稀的强碱,混合液呈碱性 D、若是强酸和强碱相混合,溶液反应后呈中性
3、同体积的PH为3 的盐酸、硫酸、醋酸和硝酸四种溶液,分别加入足量的锌粉,叙述正确的是( ) A、 硫酸溶液中放出的氢气的量最多 B、 醋酸溶液中放出的氢气的量最多 C、 盐酸和硝酸中放出的氢气的量相等 D、盐酸比硝酸放出的氢气的量多
4、向体积均是1L,PH值也相等的盐和醋酸两溶液中加入表面积质量均相等的锌块,下列叙述可能正确的是( ) A、 反应开始时,盐酸的速率比醋酸快 B、 反应过程中,醋酸的速率比盐酸快 C、 充分反应后,两者产生的氢气的体积可能相等 D、充分反应后,若有一种溶液中的锌有多余,则一定是盐酸的锌有余
5、酸HA、HB两溶液的PH值为3,且体积相同,加水稀释两溶液,PH值与加入水的体积关系如图所示,则两者酸性较强的是( )
6、酸HA、HB、HC三溶液的物质的量浓度相同,体积也相同,测得它们的PH值分别为2、2.7、3,分别与足量的锌反应,产生的氢气的物质的量 ,初始时,三者的反应速率 ,反应过程中的平均速率 ; 若三种酸的体积与PH值均相等时,分别加入足量的表面积和质量均相等的锌,初始时,三者的反应速率 ,反应过程中的平均速率_________;充分反应后,产生的氢气的物质的量的大小关系 ________,
7、判断下列说法是否正确:(1)pH=7的溶液是中性溶液。 ( )(2)H2S溶液中c(H+):c(S2-)=2:1 。 ( )(3)0.1 ml/L的HAc中c(H+)是0.2 ml/L HAc中c(H+)的1/2。 ( )(4)0.1 ml/L的HAc中c(H+) c(HAc)大于0.01 ml/L 的HAc中 c(H+) c(HAc) 。 ( )(5)0.1 ml/L的HAc中c(OH-) c(HAc)大于0.01 ml/L的HAc中c(OH-) c(HAc) 。 ( )(6)中性溶液中c(H+)=c(OH-) 。 ( )
1、定义:用已知物质的量的浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法
2、原理:在酸碱中和反应中,使用一种已知物质的量浓度的酸或碱溶液跟未知浓度的碱或酸溶液完全中和,测出二者的体积,根据化学方程式中酸和碱的物质的量的比值,就可以计算出碱或酸的溶液浓度。
(1)准确测量参加反应的两种溶液的体积
(2)准确判断中和反应是否恰好完全反应
c酸v酸=c碱v碱(一元酸和一元碱)
仪器:酸式滴定管、碱式滴定管、锥形瓶、 铁架台、滴定管夹、烧杯、白纸,有时还需要移液管
试剂:标准液、待测液、指示剂
2、酸碱指示剂:一般是有机弱酸或有机弱碱(定性测定)
对应溶液 的 颜 色
1)终点时,指示剂的颜色变化明显
2)变色范围越窄越好,对溶液的酸碱性变化较灵敏
(1)甲基橙和酚酞的变色范围较小:4.4-3.1=1.3 10-8=2 对溶液的酸碱性变化较灵敏
(2)溶液使指示剂改变颜色,发生的化学变化。指示剂滴加太多比将消耗一部分酸碱溶液(一般为1~2滴)。
(3)操作:用镊子取一小块pH试纸放在洁净的表面皿或玻璃片上,然后用玻璃棒沾取少量待测液点在试纸中央,试纸显色后再与标准比色卡比较,即知溶液的pH值。
3、pH试纸(定量测定)
(1)成分:含有多种指示剂
(2)本身颜色:淡黄色
(1)强酸强碱间的滴定:
两者正好完全反应,生成强酸弱碱盐,酸性选用甲基橙作指示剂
4、酸碱中和滴定中指示剂的选择:
两者正好完全反应,生成强碱弱酸盐,碱性选用酚酞作指示剂
三、实验步骤:
1、查漏:检查两滴定管是否漏水、堵塞和活塞转动是否灵活;
2、洗涤:用水洗净后,各用少量待装液润洗滴定管2-3次;
3、装液:用倾倒法将盐酸、氢氧化钠溶液注入酸、碱滴定管中,使液面高于刻度2-3cm
碱式滴定管:橡皮管向上翘起
调节滴定管中液面高度,并记下读数,记做。
(1)从碱式滴定管中放出25.00ml氢氧化钠溶液于锥形瓶中
(2)滴入2滴酚酞试液,将锥形瓶置于酸式滴定管下方,并在瓶底衬一张白纸。
7、滴定:左手_____________________________,右手________________________________________________眼睛_______________________________________
边滴入盐酸,边不断顺时针方向摇动,
要始终注视锥形瓶溶液的颜色变化。
9、计算:整理数据进行计算。
8、记录:当看到加一滴盐酸时,锥形瓶中溶液红色突变无色时,停止滴定,准确记下盐酸读数,并准确求得滴定用去的盐酸体积。
例题:用标准盐酸滴定未知浓度的氢氧化钠溶液(氢氧化钠放于锥形瓶中)下列操作(其它操作均正确),对氢氧化钠溶液浓度有什么影响?
一、酸式滴定管1、未用标准液(HCl)润洗酸式滴定管 ( )2、滴定管内壁不干净,滴定后,酸式滴定管内壁挂水珠 ( )3、滴定管尖嘴处有气泡,滴定后气泡消失( )4、滴定操作时,有少量盐酸滴于锥形瓶外( )5、滴定前仰视刻度,滴定后俯视刻度( )
滴定前仰视,滴定后俯视。
分析:V标偏小,导致C测偏小。
滴定前俯视,滴定后仰视。
分析:V标偏大,导致C测偏大。
二、锥形瓶6、锥形瓶内用蒸馏水洗涤后,再用待测氢氧化钠润洗 2-3次,将润洗液倒掉,再装NaOH溶液( )7、锥形瓶用蒸馏水洗后未倒尽即装NaOH溶液( )8、滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分。( )9、指示剂滴加过多( )
三、碱式滴定管10、碱式滴定管用水洗后,未用待测液润洗 ( )11、取待测液时,未将盛待测液的碱式滴定管尖嘴的气泡排除。取液后滴定管尖嘴充满溶液( )
高中化学第二节 水的电离和溶液的酸碱性示范课课件ppt: 这是一份高中化学第二节 水的电离和溶液的酸碱性示范课课件ppt,共25页。PPT课件主要包含了复习巩固,思考与交流,正反应吸热,水的电离,问题与讨论,加入酸,平衡逆向移动,但Kw保持不变,CH+,COH-等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性课文配套课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性课文配套课件ppt,共23页。PPT课件主要包含了酸碱中和滴定,H++OH-H2O,进行完全,已知浓度的溶液,未知浓度的溶液,⑶指示剂,指示剂的变色,用于配制标准液,放置滴定管,酸式滴定管等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性示范课ppt课件: 这是一份人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性示范课ppt课件,共24页。PPT课件主要包含了酸碱中和滴定,学习目标,滴定管的构造,1mL,教师演示,误差分析,读数偏大,读数偏小等内容,欢迎下载使用。













