




- 人教版 (新课标)选修4 化学反应原理 3.2 水的电离和溶液的酸碱性(第4课时 酸碱中和滴定(二)) 课件 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 3.2水的电离和溶液的酸碱性(第4课时 酸碱中和滴定(二))(课后精炼) 试卷 0 次下载
- 人教版 (新课标)选修4 化学反应原理 3.2水的电离和溶液的酸碱性(第3课时 酸碱中和滴定(一)) 课后练习 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 3.2 水的电离和溶液的酸碱性(第2课时 溶液的酸碱性与pH) 课后练习 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 3.2 水的电离和溶液的酸碱性(第2课时 溶液的酸碱性与pH) 课件 课件 0 次下载
高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性试讲课课件ppt
展开1.定义:利用中和反应,用已知物质的量浓度的酸(或碱)--标准溶液,来测定未知浓度的碱(或酸)--待测液的方法
2.原理:在酸碱中和反应中,使用一种已知物质的量浓度的酸或碱溶液跟未知浓度的碱或酸溶液完全中和,测出二者的体积,根据化学方程式中酸和碱的物质的量的比值,就可以计算出碱或酸溶液的浓度。
3.计算公式(关系式法):由中和反应得出
(1)准确测量参加反应的两种溶液的体积:精度高的仪器
(2)准确判断中和反应是否恰好完全反应:合适的指示剂
如:c酸V酸=c碱V碱(一元酸碱) c碱(待)=n碱/V碱(待)=c酸(标)V酸(标)/V碱(待)
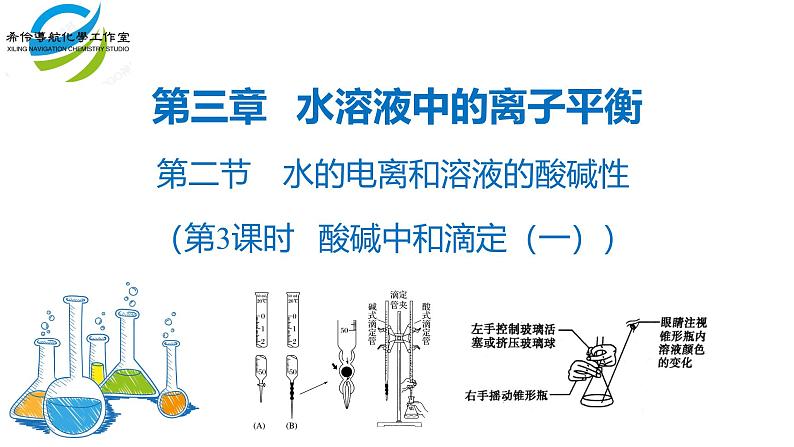
仪器:酸式滴定管、碱式滴定管、(移液管+洗耳球)、锥形瓶、 铁架台、滴定管夹、烧杯、白纸。
试剂:标准液(已知浓度)、待测液(未知浓度)、指示剂
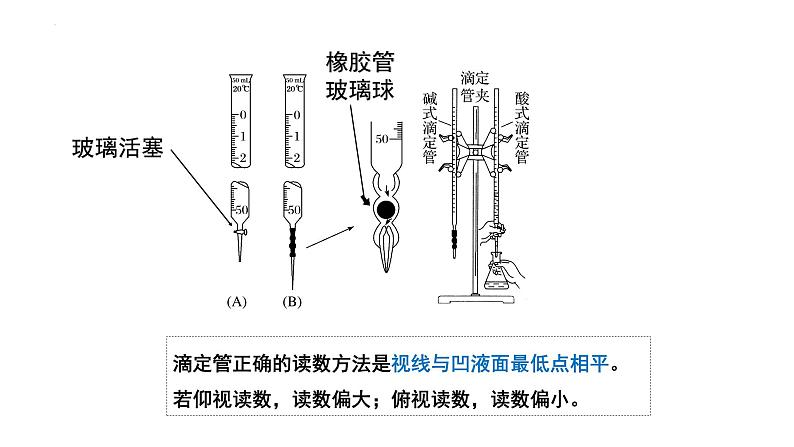
酸式滴定管:下面为磨口玻璃旋塞,可装酸性、中性、强氧化性溶液(KMnO4、K2Cr2O7、I2溶液等),不能装碱性溶液。(碱会腐蚀磨口处的玻璃:SiO2+2NaOH=Na2SiO3+H2O,生成的Na2SiO3溶液具有粘性,会粘结玻璃旋塞。 碱式滴定管:下面橡胶管,内有玻璃球,只能装碱性溶液(如Na2S2O3溶液等),不能装酸性、强氧化性溶液,因酸性、强氧化性溶液会腐蚀橡胶。
滴定管正确的读数方法是视线与凹液面最低点相平。若仰视读数,读数偏大;俯视读数,读数偏小。
酸式滴定管、碱式滴定管的共同点:(1)带有刻度且0刻度在上,最大刻度在下(不是最端);(2)最小刻度为0.1mL,可估读到0.01mL(即精确度0.01mL)(3)标有使用温度(容量瓶、量筒)(4)放液从下面放
【小试牛刀】(2022·湖北·高二期中)某学生用量程为25mL的酸式滴定管量取0.1ml•L-1的盐酸,开始时俯视液面,读数为1.00mL,取出部分溶液后,平视液面,读数为13.00mL,该同学在操作中实际取出的液体体积( ) A.大于12.00mL B.小于12.00mL C.等于12.00mL D.等于13.00mL
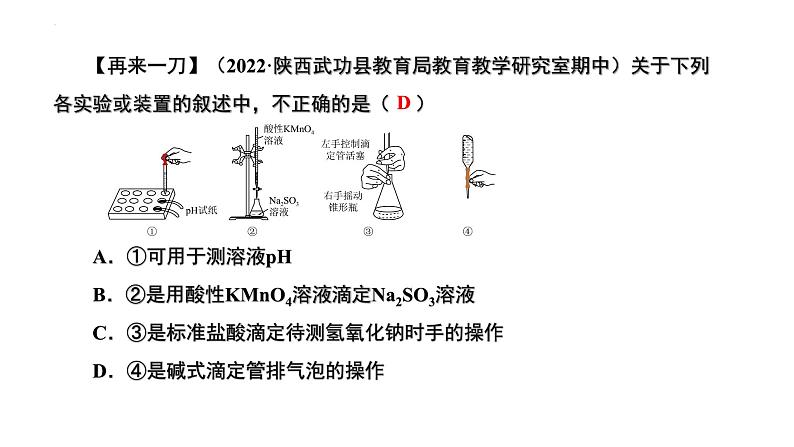
【再来一刀】(2022·陕西武功县教育局教育教学研究室期中)关于下列各实验或装置的叙述中,不正确的是( ) A.①可用于测溶液pH B.②是用酸性KMnO4溶液滴定Na2SO3溶液 C.③是标准盐酸滴定待测氢氧化钠时手的操作 D.④是碱式滴定管排气泡的操作
①终点时,指示剂的颜色变化明显
②变色范围越窄越好,对溶液的酸碱性变化较灵敏
(2)常用酸碱指示剂及变色范围:(指示剂加在待测液中)强酸与强碱的相互滴定可选酚酞或甲基橙作指示剂。石蕊不能作酸碱中和滴定的指示剂。
③用量要少,一般用2~3滴(指示剂为有机酸或有机碱)
指示剂的选择和滴定终点的判断
甲基橙 黄→橙
酚酞 红→无色
甲基橙 红→橙
酚酞 无色→粉红
强酸滴定弱碱 甲基橙 黄→橙
强碱滴定弱酸 酚酞 无色→粉红
【小试牛刀】(双选)用已知浓度的NaOH溶液滴定某H2SO4溶液的浓度,下表中正确的实验是( )
【温馨提示】滴定时标准液一般装在滴定管中、待测液一般装在锥形瓶中,指示剂加在锥形瓶中。
7.实验步骤(盐酸标准溶液滴定待测NaOH溶液)
(1)查漏:检查滴定管是否漏水(容量瓶、分液漏斗)
(2)洗涤:用水洗净后,各用少量待装液润洗滴定管2~3次
(3)装液:用倾倒法将盐酸、氢氧化钠溶液注入酸、碱滴定管中,使液面高于刻度2~3cm
碱式滴定管:橡皮管向上翘起
调节滴定管中液面至某一刻度(或0刻度),并记下读数。
①从碱式滴定管中放出20.00mL氢氧化钠溶液于锥形瓶中
②滴入2滴酚酞试液,将锥形瓶置于酸式滴定管下方,并在瓶底衬一张白纸(便于准确观察终点时溶液颜色的变化)。
(7)滴定:左手控制酸式滴定管活塞,右手拿住锥形瓶瓶颈,边滴入盐酸,边不断顺时针方向摇动,眼睛要始终注视锥形瓶溶液的颜色变化。滴定时先快后慢,成滴不成线,接近终点时逐滴加入。
(9)计算:标准溶液的体积取3次的平均值进行计算。 (注意:三次的测定值中相差太大的--0.2mL以上,应舍去)
(8)记录:当看到加滴入最后一滴盐酸时,锥形瓶中的溶液由浅红色变为无色且半分钟不恢复颜色(终点颜色变化)时(滴定终点),停止滴定,准确记下盐酸的读数(视线与凹液面最低点水平相切),并准确求得滴定用去的盐酸体积。重复以上操作2~3次。(数据记录表格如下)
【小试牛刀】用0.100ml/L的NaOH标准溶液滴定未知浓度的盐酸,数据记录如下,计算盐酸的浓度?
【再来一刀】试叙述由强酸滴定强碱分别以酚酞、甲基橙作指示剂时终点的颜色变化(现象)?强碱滴定强酸分别以酚酞、甲基橙作指示剂时终点的颜色变化(现象)?
1.用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸时,下列操作会导致测定结果偏高的是( ) A.酸式滴定管用蒸馏水洗净后,直接注入未知浓度的盐酸 B.锥形瓶用蒸馏水洗净后,直接注入未知浓度的盐酸 C.滴定前,碱式滴定管尖嘴部分有气泡;滴定后,气泡没有了 D.读数时,视线与滴定管内液体的凹液面的最低处保持水平
2.(2021·鄂尔多斯市第一中学高二月考)下列滴定中,指示剂的选择或滴定终点颜色变化有错误的是( )
3.(2022·江西·赣州市第三中学期中)下列实验操作正确的是( ) A.用图1装置进行KMnO4溶液滴定未知浓度的FeSO4溶液实验 B.如图2所示,记录滴定终点读数为19.90mL C.图3为酸式滴定管,使用后需洗涤干净,并轻轻放入烘箱烘干 D.碱式滴定管排气泡的操作方法如图4,然后轻轻挤压玻璃球使尖嘴部分充满碱液
人教版 (新课标)选修4 化学反应原理第三章 水溶液中的离子平衡第二节 水的电离和溶液的酸碱性一等奖课件ppt: 这是一份人教版 (新课标)选修4 化学反应原理<a href="/hx/tb_c22171_t3/?tag_id=26" target="_blank">第三章 水溶液中的离子平衡第二节 水的电离和溶液的酸碱性一等奖课件ppt</a>,共23页。PPT课件主要包含了组织建设,无影响,滴定管读数正误对比,读数误差,无法判断舍去,容量瓶,cV200ρ,十酸碱滴定突跃,滴定曲线等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性优质课ppt课件: 这是一份人教版 (新课标)选修4 化学反应原理<a href="/hx/tb_c22171_t3/?tag_id=26" target="_blank">第二节 水的电离和溶液的酸碱性优质课ppt课件</a>,共16页。PPT课件主要包含了水的电离,K电离=等内容,欢迎下载使用。
化学选择性必修1第二单元 溶液的酸碱性授课ppt课件: 这是一份化学选择性必修1第二单元 溶液的酸碱性授课ppt课件,共18页。PPT课件主要包含了学习目标,工业生产,农业生产,环保领域,交流讨论,酸碱中和滴定原理,中和滴定主要仪器,滴定管,酸式滴定管,碱式滴定管等内容,欢迎下载使用。













