


人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性教学演示ppt课件
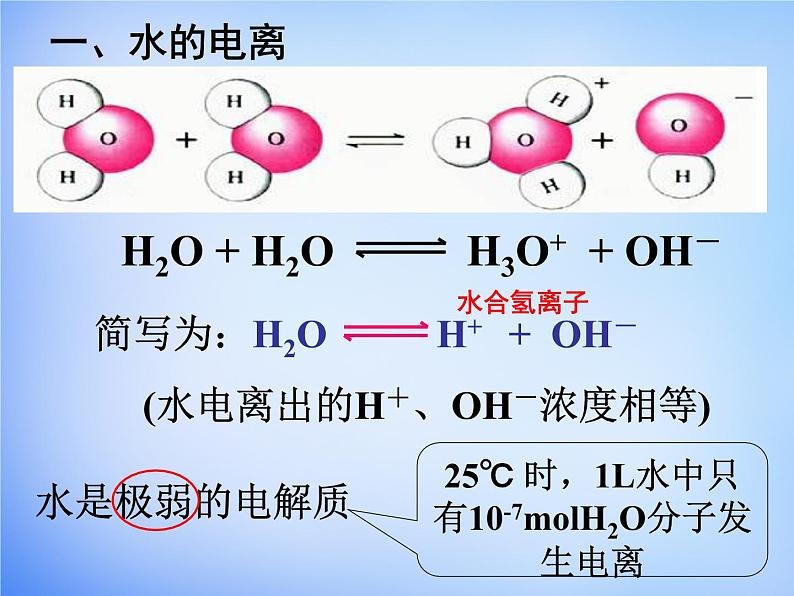
展开25℃ 时,1L水中只有10-7mlH2O分子发生电离
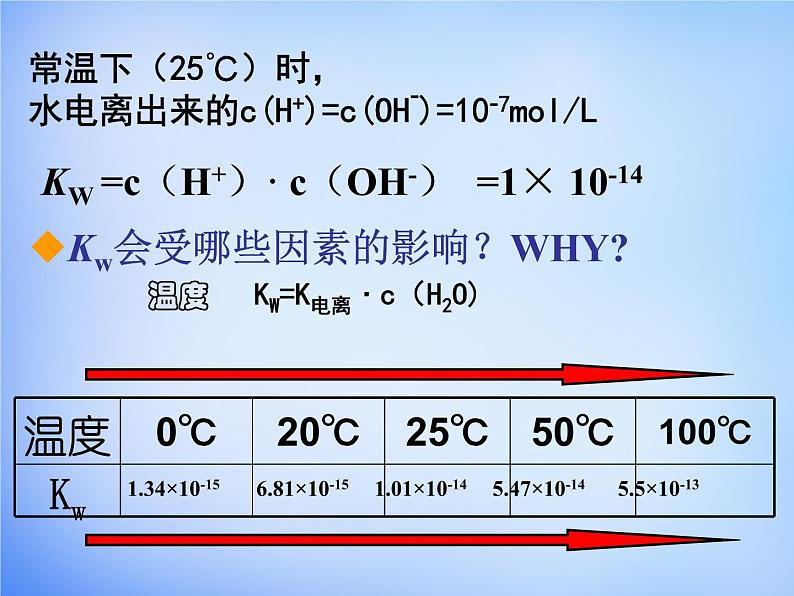
其中常数K电离与常数c(H2O)的积记为Kw,称为水的离子积常数,简称水的为离子积。
KW =c(H+)· c(OH-) =1× 10-14
温度 KW=K电离 · c(H2O)
常温下(25℃)时,水电离出来的c(H+)=c(OH-)=10-7ml/L
1.34×10-15 6.81×10-15 1.01×10-14 5.47×10-14 5.5×10-13
Kw会受哪些因素的影响?WHY?
升高温度:平衡向 移动 c(H+ ) _______ ,c(OH-)________ , Kw——————
注意:(1)水的离子积只随温度的改变而改变。
H2O H+ + OH-
(2)Kw 不仅适用于纯水,也适用于酸碱盐的稀溶液。
KW =c(H+)· c (OH-)
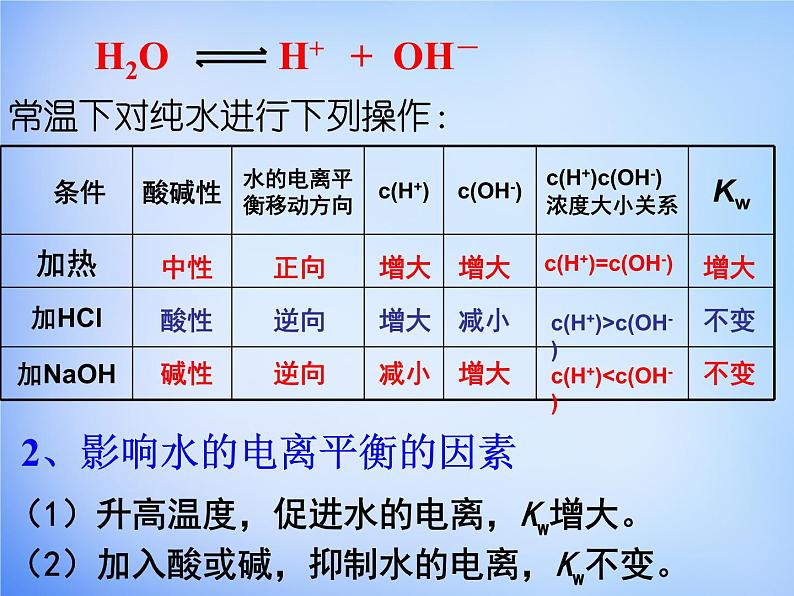
常温下对纯水进行下列操作:
(2)加入酸或碱,抑制水的电离,Kw不变。
c(H+)>c(OH-)
c(H+)
c(H+)=c(OH-)
2、影响水的电离平衡的因素
1、室温下,在水中加入少量盐酸,水的离子积是否发生改变?加入少量氢氧化钠呢?
外界对 c ( H+) 或c( OH-) 所做的改变,结果仍然是: KW=K电离·c(H2O)= c ( H+) ·c( OH-) Kw并不随溶液中的c ( H+) 或c( OH-) 的改变而改变。这是Kw的特点。
2、在酸、碱稀溶液中,水电离出来的c ( H+) 和c( OH-) 是否相等?
完成教材p46的思考与交流, 分析电解质溶液呈酸碱性的本质原因?
c(H+) >c(OH-)
c(H+) =c(OH-)
c(H+) <c(OH-)
无论任何温度,无论酸性、中性、碱性溶液,都存在水电离出的H+、OH-,并且由水电离出的这两种离子的浓度一定相等。
溶液中的c(H+) 和c(OH-)
电解质溶液呈酸碱性是由c(H+)与 c(OH-)的相对大小决定的。
1、如果c(H+)不等于c(OH-)则溶液一定呈现酸碱性。
2、在水中加酸会抑制水的电离,电离程度减小。
3、如果c(H+)/c(OH-)的值越大则酸性越强。
4、任何水溶液中都有c(H+)和c(OH-)。
5、c(H+)等于10-6ml/L的溶液一定呈现酸性。
6、对水升高温度电离程度增大,酸性增强。
2. 0.1ml/L的NaOH溶液中, c(OH-)= , c(H+)= 。 由水电离出的c(OH-)水= , c(H+)水= 。
1. 0.1ml/L的盐酸溶液中, c(H+)= , c(OH-)= 。 由水电离出的c(OH-)水= , c(H+)水= 。
3. 0.1ml/L的NaCl溶液中, c(OH-)= ,c(H+)= 。
1、下列微粒中不能破坏水的电离平衡的是( ) A、H+ B、OH- C、S2- D、Na+
高中化学第二节 水的电离和溶液的酸碱性示范课课件ppt: 这是一份高中化学第二节 水的电离和溶液的酸碱性示范课课件ppt,共25页。PPT课件主要包含了复习巩固,思考与交流,正反应吸热,水的电离,问题与讨论,加入酸,平衡逆向移动,但Kw保持不变,CH+,COH-等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性备课课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性备课课件ppt,共14页。PPT课件主要包含了水的电离,写出水的电离方程式,简写为,注常数无单位,影响KW的因素,水的电离平衡的移动,中性溶液,酸性溶液,碱性溶液,试纸的使用方法等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性课文配套课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性课文配套课件ppt,共23页。PPT课件主要包含了酸碱中和滴定,H++OH-H2O,进行完全,已知浓度的溶液,未知浓度的溶液,⑶指示剂,指示剂的变色,用于配制标准液,放置滴定管,酸式滴定管等内容,欢迎下载使用。













