



人教版 (2019)选择性必修1第一节 电离平衡教课内容课件ppt
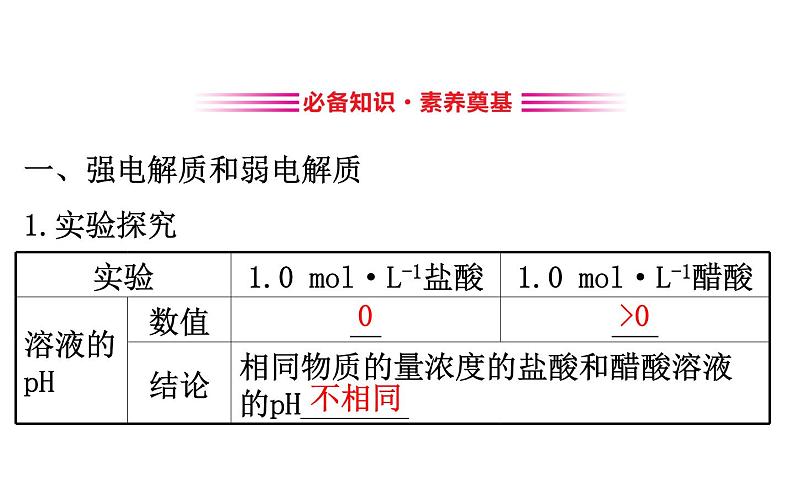
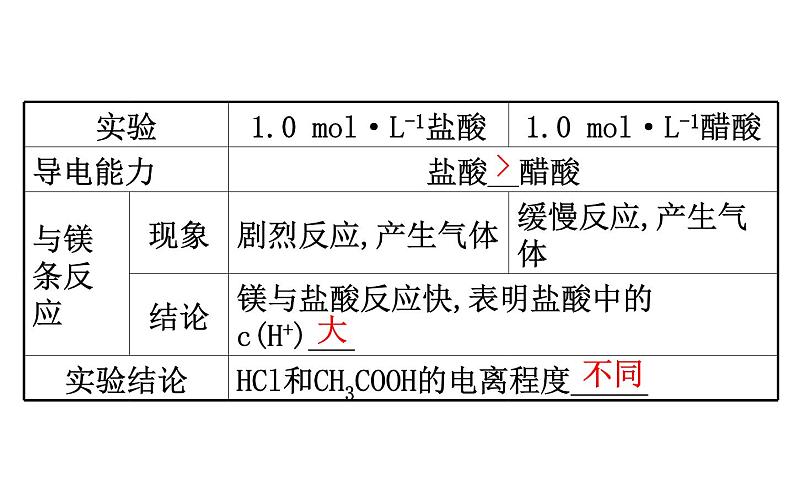
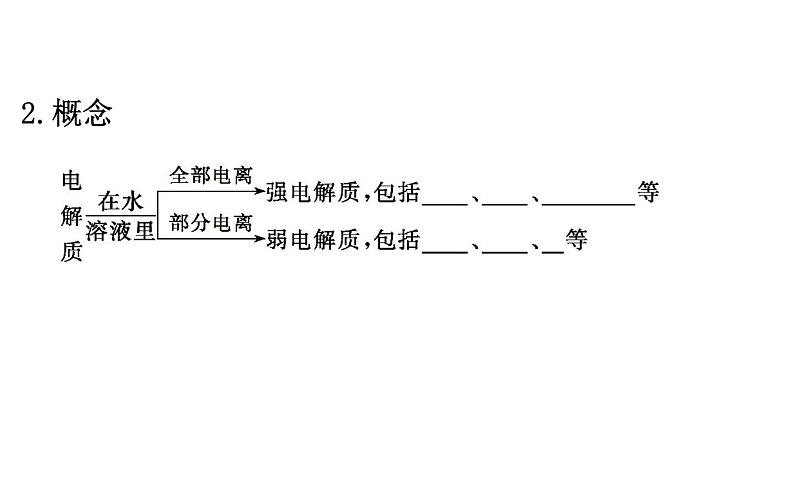
展开一、强电解质和弱电解质1.实验探究
【巧判断】(1)强电解质稀溶液中不存在溶质分子,弱电解质稀溶液中存在溶质分子。( )提示:√。在水溶液中,强电解质完全电离,弱电解质不能完全电离。(2)酸HR溶液的导电性较弱,HR属于弱酸。( )提示:×。导电性强弱与酸性强弱没有必然联系,强酸的稀溶液导电性也较弱。
【想一想】难溶于水的盐(如BaSO4)一定就是弱电解质吗?提示:不一定。电解质的强弱与其电离程度有关,与其溶解性无关,与其溶液导电能力强弱没有必然联系。
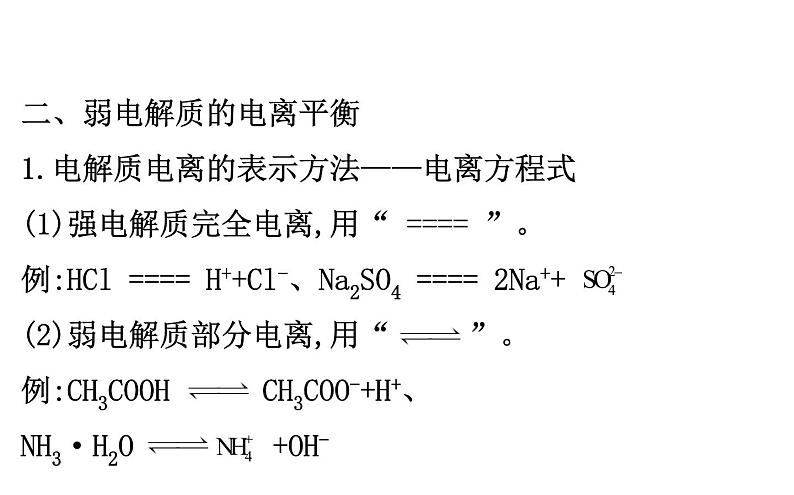
二、弱电解质的电离平衡1.电解质电离的表示方法——电离方程式(1)强电解质完全电离,用“ ==== ”。例:HCl ==== H++Cl-、Na2SO4 ==== 2Na++ (2)弱电解质部分电离,用“ ”。例:CH3COOH CH3COO-+H+、NH3·H2O +OH-
【情境·思考】碳酸饮料(汽水)是指在一定条件下充入二氧化碳气体的饮料。其主要成分包括:碳酸水、柠檬酸等酸性物质。
二氧化碳溶于水生成碳酸,那么碳酸的电离方程式如何书写?电离出几种离子?提示:H2CO3 +H+, +H+,故电离出三种离子H+、 、 。
2.电离平衡的概念一定条件(如温度、浓度)下,弱电解质分子电离成离子的速率和离子结合成弱电解质分子的速率_____时,电离过程达到平衡状态。
3.电离平衡的建立①开始时,v电离_____,而v结合为__。②平衡的建立过程中,v电离__v结合。③当v电离__v结合时,电离过程达到平衡状态。
4.外界因素对电离平衡的影响
【巧判断】(1)弱电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度一定相等。( )提示:×。达到电离平衡时,分子的浓度和离子的浓度不再改变,并不一定相等。
(2)改变条件使电离平衡正向移动,电离程度一定增大。 ( )提示:×。若增加弱电解质溶液的浓度,电离平衡正向移动,但电离程度减小。
【情境·思考】柠檬水(含柠檬酸)是生活中常见的保健饮料,人们发现柠檬水温度升高,酸味就会更浓郁,人对酸味的感觉随温度升高而增强。这是为什么呢?
提示:柠檬酸为弱酸,升温后,柠檬酸的电离程度随温度升高而加大,氢离子浓度增大,酸味感觉更浓。
三、电离平衡常数1.电离常数
2.多元弱酸(或弱碱)的电离常数(1)表达式多元弱酸(或弱碱)的每一步都有电离常数,以碳酸为例:H2CO3 +H+,Ka1= +H+,Ka2=
(2)大小关系及应用①Ka1≫Ka2,Kb1≫Kb2。②应用:计算或比较多元弱酸(或弱碱)的酸性(或碱性)时,通常只考虑第一步电离。
【巧判断】(1)H2CO3的电离常数表达式:Ka= 。( )提示:×。H2CO3是弱电解质,不能完全电离,其第一步电离常数为Ka1= ,第二步电离常数为Ka2= 。
(2)弱电解质的电离平衡右移,电离平衡常数一定增大。( )提示:×。电离平衡常数只受温度影响。未指明弱电解质的电离平衡右移的原因,故电离平衡常数不一定增大。
【微思考】能否根据醋酸溶液与碳酸钠溶液反应的现象,判断醋酸的Ka和碳酸的Ka1的大小?提示:可以。反应中有气泡产生,即发生反应:2CH3COOH+Na2CO3 ==== 2CH3COONa+H2O+CO2↑,说明醋酸的酸性大于碳酸,则Ka>Ka1。
知识点一 强、弱电解质的比较【重点释疑】强电解质和弱电解质的比较
【易错提醒】 电解质强弱判断的易错点(1)电解质的强弱与溶液导电能力无必然联系,即溶液导电能力的强弱只与溶液中离子浓度的大小以及离子所带电荷数目的多少有关。
(2)电解质的强弱与其溶解度无关。某些难溶或微溶于水的盐(如CaCO3、AgCl、BaSO4等),虽然其溶解度很小,但是其溶于水的部分却是完全电离的,它们仍属于强电解质。(3)活泼金属氧化物在熔融状态下完全电离,属于强电解质。
【知识拓展】 强弱电解质与化合物类型的关系
【思考·讨论】强电解质溶液的导电能力一定强,弱电解质溶液的导电能力一定弱吗?溶液的导电能力取决于什么?提示:不一定。溶液的导电能力取决于溶液中自由移动离子的浓度和所带电荷数,溶液中自由移动离子的浓度越大,所带电荷越多,则导电能力越强。而电解质的强
弱是指电解质在水溶液中的电离情况,二者无必然关系,即强电解质溶液的导电能力不一定强,弱电解质溶液的导电能力不一定弱。
【案例示范】【典例】(2020·南通高二检测)下列事实中一定不能证明CH3COOH是弱电解质的是( )①等物质的量浓度、等体积的盐酸、CH3COOH溶液和足量锌反应,根据产生氢气的多少②用CH3COOH溶液做导电实验,灯泡很暗
③等c(H+)、等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多④0.1 ml·L-1 CH3COOH溶液的c(H+)=1.0×10-2 ml·L-1⑤CH3COONa和H3PO4反应,生成CH3COOHA.①② B.②⑤ C.①③⑤ D.③④⑤
【解题指南】解答本题需注意以下两点:(1)强弱电解质的本质区别是电离程度大小;(2)反应“较强酸+较弱酸的盐=较弱酸+较强酸的盐”能够发生。
【解析】选A。①等物质的量浓度、等体积的盐酸、CH3COOH溶液中酸的物质的量相同,和足量锌反应,产生氢气一样多,故无法判断酸的强弱;②中未指明浓度,也没有参照物,不能说明问题;③说明电离前n(CH3COOH)>n(盐酸),故CH3COOH的电离程度比盐酸小,是弱电解质;④中说明c(H+)
【母题追问】(1)①中“产生氢气的多少”改为“产生氢气的速率”是否符合题意? 为什么?提示:符合。产生氢气的速率是由c(H+)决定的,醋酸的速率慢,说明c(H+)小,没有全部电离。
(2)已知电离度α= ×100%,则④中的电离度为____________。 提示:10%。由电离度的表达式知α= ×100%=10%。
【规律方法】证明弱电解质的常见方法要证明某电解质是弱电解质,关键在于一个“弱”字,即证明它只是部分电离或其溶液中存在电离平衡。以一元弱酸HA为例,证明它是弱电解质的常用方法有
结论:HA是一元弱酸,是弱电解质.其中第4、5项还能证明HA的酸性比H2CO3弱
【迁移·应用】1.用食用白醋(醋酸浓度约1 ml·L-1)进行下列实验,能证明醋酸为弱电解质的是( )A.白醋中滴入石蕊试液呈红色B.白醋加入豆浆中有沉淀产生C.蛋壳浸泡在白醋中有气体放出D.pH试纸显示白醋的pH为2~3
【解析】选D。石蕊试液遇c(H+)>10-5 ml·L-1的溶液都可能会呈红色;白醋加入豆浆中有沉淀产生,原因是豆浆为胶体,遇到电解质会发生聚沉;白醋与蛋壳中的CaCO3反应放出CO2气体,能说明CH3COOH的酸性比H2CO3强,但不能说明CH3COOH是弱酸;浓度为1 ml·L-1的CH3COOH溶液,若是强电解质,则pH为0,而实际pH为2~3,则说明CH3COOH没有完全电离,从而证明CH3COOH为弱电解质。
2.(2020·长春高二检测)关于强、弱电解质叙述正确的是( )A.强电解质都是离子化合物,弱电解质都是共价化合物B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物C.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子D.强电解质的水溶液导电能力强,弱电解质的水溶液导电能力弱
【解析】选C。判断强、弱电解质的关键是看化合物自身是否能在水中全部电离成离子,强电解质在水中完全电离,无溶质分子,弱电解质在水中部分电离,有离子也有溶质分子,从电解质的结构来看,强电解质包括离子化合物和含强极性键的共价化合物,故A错误,C正确;电解质的强弱与电解质的溶解性、导电能力强弱之间没有必然联系,如CaCO3难溶于水,但其溶于水的部分全部电离,故CaCO3为强电解质,B、D错误。
【补偿训练】1.(2020·太原高二检测)下列各组物质全都是弱电解质的是( )A.H2O、NH3·H2O、H3PO4、HFB.Cu(OH)2、CH3COOH、C2H5OH、CH3COONaC.H2SO3、Ba(OH)2、BaSO4 D.H2SiO3、H2S、CO2
【解析】选A。B项中CH3COONa属于强电解质,C2H5OH为非电解质;C项中Ba(OH)2、BaSO4属于强电解质;D项中CO2属于非电解质。
2.甲酸(HCOOH)是一种一元弱酸,下列性质中可以证明它是弱电解质的是( )A.常温下,1 ml·L-1甲酸溶液中的c(H+)约为1×10-2 ml·L-1B.甲酸能与碳酸钠反应放出二氧化碳C.10 mL 1 ml·L-1甲酸溶液恰好与10 mL 1 ml·L-1 NaOH溶液完全反应D.甲酸溶液与锌反应比强酸溶液缓慢
【解析】选A。若能说明甲酸只发生部分电离,便可以证明它是弱电解质。A项,c(H+)
1910年时,大部分的冰醋酸提取自干馏木材得到的煤焦油中。其工艺首先是将煤焦油通过氢氧化钙处理,然后将形成的乙酸钙用硫酸酸化,得到其中的乙酸。(1)以上制备冰醋酸的反应原理,能否说明乙酸为弱酸?提示:不能。该反应只能证明硫酸的酸性大于乙酸,但不能说明乙酸就是弱酸。
(2)某小组在一定温度下,将冰醋酸加水稀释,溶液的导电能力I随加入水的体积V变化的曲线如图所示。
① “O”点导电能力为0的理由是什么?提示:在“O”点处醋酸未电离,无离子存在。②a、b、c三点处,溶液的c(H+)由小到大的顺序为什么?提示:c
知识点二 弱电解质的电离平衡【重点释疑】1.电离平衡的特征
2.外界条件对电离平衡的影响
【易错提醒】(1)弱电解质的电离都是微弱的。一般来说已电离的分子是极少数的,绝大多数以分子形式存在。(2)弱电解质电离平衡后,加水稀释,电离程度增大,但电解质分子、电解质电离出的离子(包括H+或OH-)浓度减小。判断离子浓度比值变化时,只考虑物质的量的比值即可。
(3)多元弱酸分步电离,第一步电离出相对较多的H+,对第二步电离起到抑制作用,第二步电离程度大大减弱。故K1远远大于K2。
【思考·讨论】电离平衡向右移动,电离程度、离子浓度一定增大吗?举例说明。 提示:不一定,如向氨水中通入NH3,电离平衡右移,而NH3·H2O电离程度减小;若向氨水中加水,电离平衡右移,但c( )、c(OH-)均减小。
【案例示范】【典例】(2020·咸阳高二检测)在0.1 ml·L-1的NH3·H2O溶液中存在如下电离平衡:NH3·H2O +OH-。下列叙述正确的是( )A.加入少量浓盐酸,平衡逆向移动B.加入少量NaOH固体,平衡正向移动C.加入少量0.1 ml·L-1NH4Cl溶液,溶液中c(OH-)减小D.加入少量MgSO4固体,溶液pH增大
【解题指南】解答本题要注意以下三点:(1)当某些条件发生改变时电离平衡会发生移动;(2)加入不同物质后引起溶液中原有离子的变化趋势;(3)受离子浓度变化影响,平衡体系如何移动。
【解析】选C。本题主要考查电离平衡的影响因素,对于平衡体系NH3·H2O +OH-加入少量浓盐酸,发生H++OH- ==== H2O,使OH-浓度降低,平衡正向移动;加入少量NaOH固体,使OH-浓度升高,平衡逆向移动;加入少量0.1 ml·L-1NH4Cl溶液,使 浓度升高,平衡逆向移动,溶液中c(OH-)减小;加入少量MgSO4固体,发生Mg2++2OH- ==== Mg(OH)2↓,溶液中c(OH-)减小。
【母题追问】(1)若向溶液中通入NH3平衡会如何移动? 提示:若向溶液中通入NH3,则会增大NH3·H2O的浓度,使平衡向右移动。(2)若向上述溶液中加水,平衡会如何移动?溶液碱性会如何变化? 提示:加水,平衡正向移动,但c(OH-)减小,溶液碱性减弱。
【迁移·应用】1.已知0.1 ml·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中 的值增大,可以采取的措施是( )①加少量烧碱固体 ②升高温度 ③加少量冰醋酸 ④加水A.①② B.②③ C.③④ D.②④
【解析】选D。①中,加少量NaOH时,H+与OH-结合生成难电离的H2O,使 的值减小。②中,CH3COOH的电离是吸热反应,升温,c(H+)增大,c(CH3COOH)减小,故 的值增大。③中,加入无水CH3COOH时,c(CH3COOH)增大量大于c(H+)增大量,致使 的值减小。④中,加水稀释电离平衡右移,n(CH3COOH)
减小,n(H+)增大。因两者处于同一体系中,体积相等,故 的值增大。
2.(2020·长沙高二检测)在相同温度时,100 mL 0.01 ml·L-1的醋酸溶液与10 mL 0.1 ml·L-1的醋酸溶液相比较,下列数值前者大于后者的是( )A.中和时所需NaOH的量B.H+的物质的量浓度C.H+的物质的量D.CH3COOH的物质的量
【解析】选C。这两种醋酸中的n(CH3COOH)相同,中和NaOH的能力相同,但因为浓度不同,电离程度前者大于后者,所以H+的物质的量前者大,又因为溶液的体积不一样,H+的物质的量浓度前者小。
【补偿训练】1.(2020·宜昌高二检测)室温时,在0.1 ml·L-1的NH3·H2O溶液中,要促进NH3·H2O电离,且氢氧根离子浓度增大,应采取的措施是( )A.升温至30 ℃ B.降温C.加入NaOH溶液 D.加入稀盐酸
【解析】选A。根据NH3·H2O +OH- ΔH>0。升温促进NH3·H2O的电离,c(OH-)增大,A正确;降温抑制NH3·H2O电离,c(OH-)减小,B错误;加入NaOH溶液,c(OH-)增大,抑制NH3·H2O的电离,C错误;加入稀盐酸,由于H++OH- ==== H2O,促进NH3·H2O的电离,c(OH-)降低,D错误。
2.将1 ml冰醋酸加入一定量的蒸馏水中最终得到1 L溶液。下列各项中,表明已达到电离平衡状态的是( )A.c(CH3COOH)达到1 ml·L-1B.c(H+)的浓度达到0.5 ml·L-1C.c(CH3COOH)、c(CH3COO-)、c(H+)的浓度相等D.醋酸分子电离成离子的速率和离子重新结合成醋酸分子的速率相等
【解析】选D。在未电离时c(CH3COOH)=1 ml·L-1,当醋酸、H+、CH3COO-的浓度不再变化时(但此时三者的浓度不一定是0.5 ml·L-1),醋酸的电离达到平衡状态,故A、B、C均错误。依据平衡状态的标志即电离成离子的速率与离子结合成分子的速率相等,可知D正确。
【素养提升】蚊虫、蚂蚁等叮咬人时,常向人体血液注入一种含有蚁酸(甲酸,HCOOH)的液体,皮肤上会起小疱。
(1)已知SO2+H2O+HCOONa ==== NaHSO3+HCOOH,HCOOH属于强电解质还是弱电解质?写出甲酸在溶液中的电离方程式。(宏观辨识与微观探析)(2)蚊虫叮咬后皮肤上所起的小疱,即使不治疗,过一段时间小疱也能自行痊愈,其原因是什么?(证据推理与模型认知)
(3)有同学认为,受到蚂蚁叮咬时及时涂抹稀氨水或肥皂水能起到治疗作用,这一观点是否正确?请说明理由。(证据推理与模型认知)【解析】(1)根据SO2+H2O+HCOONa ==== NaHSO3+HCOOH,结合强酸制弱酸原理,可知酸性:H2SO3>HCOOH,又因H2SO3属于弱酸,故HCOOH属于弱电解质。电离方程式为HCOOH H++HCOO-。
(2)蚊虫、蚂蚁等叮咬人时,向人体血液中注入了HCOOH,增加了血液中H+浓度,使H2CO3的电离平衡向生成CO2的方向移动,从而导致皮肤上出现小疱。一段时间后,小疱内的CO2和H2O作用重新达到电离平衡状态,血液中恢复原先的酸碱平衡而自行痊愈。(3)由于稀氨水或肥皂水都是碱性溶液,能与HCOOH反应从而起到治疗作用。
答案:(1)弱电解质 HCOOH H++HCOO-。(2)蚊虫、蚂蚁等叮咬人时,向人体血液中注入了HCOOH,增加了血液中H+浓度,使H2CO3的电离平衡向生成CO2的方向移动,从而导致皮肤上出现小疱。一段时间后,小疱内的CO2和H2O作用重新达到电离平衡状态,血液中恢复原先的酸碱平衡而自行痊愈。
(3)正确 由于稀氨水或肥皂水都是碱性溶液,能与HCOOH反应从而起到治疗作用。
知识点三 电离平衡常数及其应用【重点释疑】1.电离平衡常数的4大应用(1)判断弱酸(或弱碱)的相对强弱,电离平衡常数越大,酸性(或碱性)越强。(2)判断复分解反应能否发生,一般符合“强酸制弱酸”规律。
(3)判断溶液中微粒浓度比值的变化。如加水稀释醋酸溶液,由Ka(CH3COOH)= 不变,稀释后c(CH3COO-)减小,则 增大。(4)计算弱酸或弱碱溶液中电离出离子的浓度。
2.电离常数的相关计算(以弱酸HX为例) HX H+ + X-起始(ml·L-1):c0(HX) 0 0平衡(ml·L-1):c0(HX)-c(H+)c(H+)c(H+)则K=
(1)已知c0(HX)和c(H+),求电离平衡常数由于弱酸只有极少一部分电离,c(H+)的数值很小,可做近似处理:c0(HX)-c(H+)≈c0(HX),则K≈ ,代入数值求解即可。
(2)已知c0(HX)的电离平衡常数,求c(H+)由于K值很小,c(H+)的数值很小,可做近似处理:c0(HX)-c(H+)≈c0(HX),则:c(H+)≈ ,代入数值求解即可。
【思考·讨论】(1)将一元弱酸HB的稀溶液加水稀释,能使HB的电离平衡右移,电离平衡常数增大,这种说法正确吗?并说明理由。提示:不正确。加水稀释能使HB的电离平衡右移,但电离平衡常数只受温度影响,温度升高Ka(HB)增大,加水时温度不变,Ka(HB)不变。
(2)已知在25 ℃时,次氯酸的电离平衡常数为Ka=2.95×10-8,碳酸的电离平衡常数为K1=4.30×10-7、K2=5.61×10-11,反应Cl2+H2O HCl+HClO达到平衡后,要使HClO浓度增加,可以加入什么物质?(供选择的物质有:NaOH固体、CaCO3固体、H2O)
提示:按照题目的要求要使平衡正向移动,但是不能消耗HClO,CaCO3能消耗HCl,但是不会消耗HClO,由电离平衡常数知酸性:H2CO3>HClO> ,由“强酸制弱酸”确定选CaCO3固体。
【案例示范】【典例1】已知下面三个数据:6.3×10-4、5.6×10-4、6.2×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2 ==== HCN+NaNO2; NaNO2+HF ==== HNO2+NaF。由此可判断下列叙述不正确的是( )A.Ka(HF)=6.3×10-4B.Ka(HNO2)=6.2×10-10C.三种酸的强弱顺序为HF>HNO2>HCND.Ka(HCN)
【解析】选B。相同温度下弱电解质的电离常数的大小是比较弱电解质相对强弱的条件之一。根据题中反应可知三种一元弱酸的酸性强弱顺序为HF>HNO2>HCN,由此可判断:Ka(HF)>Ka(HNO2)>Ka(HCN),其对应数据依次为Ka(HF)=6.3×10-4、Ka(HNO2)=5.6×10-4、Ka(HCN)=6.2×10-10。
【母题追问】(1)反应HCN+NaF ==== NaCN+HF能否发生?为什么?提示:不能。上题分析酸性HF>HCN,根据“强酸制弱酸”规律判断该反应不能发生。
(2)上题Ka=6.2×10-10的0.1 ml·L-1的溶液中c(H+)约为多少?提示:由分析知Ka(HCN)=6.2×10-10,溶液中c(H+)≈c(CN-),c(HCN) ≈0.1 ml·L-1,则 =6.2×10-10,则c(H+)≈7.9×10-6。
【典例2】(2020·聊城高二检测)已知25 ℃时,测得浓度为0.1 ml·L-1的碱BOH的溶液中,c(OH-)=1×10-3 ml·L-1。(1)写出BOH的电离方程式_____________________; (2)BOH的电离平衡常数K=_____________________。
(3)某温度t ℃时,BOH的电离平衡常数为1×10-7,结合(2)的计算可知t ℃____________25 ℃。若该碱的起始浓度也为0.1 ml·L-1,则溶液中c(B+)=__________ml·L-1。
【思维建模】解答有关电离常数计算思维流程如下:
【解析】(1)因c(BOH)初始=0.1 ml·L-1,c(BOH)电离=c(B+)≈c(OH-)=1×10-3 ml·L-1,则BOH不完全电离,故电离方程式为BOH B++OH-。(2)电离平衡时c(BOH)平衡=0.1 ml·L-1-1×10-3 ml·L-1≈0.1 ml·L-1,则电离常数K= =1×10-5。
(3)电离过程是吸热的,温度越高电离常数越大,t ℃时BOH的电离平衡常数为1×10-7<1×10-5,则t ℃<25 ℃。电离常数K= =1×10-7,则c(B+)=1×10-4 ml·L-1。答案:(1)BOH B++OH- (2)1×10-5(3)< 1×10-4
【迁移·应用】下表是常温下某些一元弱酸的电离常数:则0.1 ml·L-1的下列溶液中,c(H+)最大的是( )A.HCN B.HF C.CH3COOH D.HNO2
【解析】选B。一元弱酸的电离常数越大,电离程度越大,同浓度时产生的c(H+)越大。
【补偿训练】1.(2020·石家庄高二检测)25 ℃时,下列有关电解质溶液的说法正确的是( )A.加水稀释0.1 ml·L-1氨水,溶液中c(H+)·c(OH-)和c(H+)/c(OH-)的值保持不变B.向CH3COONa溶液中加入少量CH3COONa,溶液中c(CH3COO-)/c(CH3COOH)的值增大
C.等体积、等物质的量浓度的Na2CO3和NaHCO3溶液混合: D.将浓度为0.1 ml·L-1 HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变, 始终增大
【解析】选B。A项中,0.1 ml·L-1氨水稀释过程中c(H+)增大,c(OH-)减小,因而比值变大,错误;B项,向CH3COONa溶液中加入少量CH3COONa,溶液中 ,加入CH3COONa,溶液碱性增强,则c(H+)降低,所以 的值增大,正确;C项,等体积、等物质的量浓度的Na2CO3和NaHCO3溶液混合,根据电离常数有Ka1= 、Ka2= ,同一溶液中c(H+)相
等,则c(H+)=Ka1· =Ka2· ,而Ka1>Ka2,则 ,错误;D项,0.1 ml·L-1的HF加水稀释,c(F-)趋近于0,而c(H+)趋于不变(10-7 ml·L-1),故比值变小,错误。
2.(1)0.1 ml·L-1醋酸溶液中,存在电离平衡CH3COOH H++CH3COO-。经测定溶液中c(CH3COO-)为1.4×10-3 ml·L-1,此温度下醋酸的电离常数Ka=_______________。
(2)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 ml·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 +H+的平衡常数K1=__________。(已知:10-5.60=2.5×10-6)
【解析】(1) CH3COOH CH3COO- + H+起始(ml·L-1)0.1 0 0平衡(ml·L-1)0.1-1.4×10-3 1.4×10-3 1.4×10-3Ka= =1.96×10-5。
(2)H2CO3 H++ K1= ≈4.2×10-7。答案:(1)1.96×10-5 (2)4.2×10-7
【素养提升】2019年11月8日,据欧盟官方公报消息,欧盟委员会发布条例,修订芥酸和氢氰酸在部分食品中的最大含量。氢氰酸及部分弱酸的电离常数如下表:
(1)依据表格中三种酸的电离常数,判断三种酸酸性强弱的顺序为___________________。 (2)向NaCN溶液中通入CO2气体能否制得HCN?______。若能写出反应的化学方程式___________________。
(3)同浓度的HCOO-、 、 、CN-结合H+的能力由强到弱的顺序是______________________________。 (4)①升高0.1 ml·L-1 HCN溶液的温度,HCN的电离程度如何变化?_________________________________。 ②加水稀释, 如何变化?__________________。
【解析】(1)电离常数越大酸性越强,依据表格中三种酸的电离常数,判断三种酸酸性强弱的顺序为HCOOH>H2CO3>HCN。(2)由于K1(H2CO3)>K(HCN)>K2(H2CO3),向NaCN溶液中通入CO2气体可制得HCN,但只能生成NaHCO3,不能生成Na2CO3。
(3)电离常数越大,逆反应的常数越小,即结合H+的能力越小。(4)①升高温度促进电离,HCN的电离程度增大。②加水稀释,c(CN-)减小,由于电离常数不变,则 增大。
答案:(1)HCOOH>H2CO3>HCN(2)能 NaCN+H2O+CO2 ==== HCN+NaHCO3(3) >CN-> >HCOO-(4)①升高温度,能促进HCN的电离 ②加水稀释, 增大
化学选择性必修1第一节 电离平衡获奖课件ppt: 这是一份化学选择性必修1第一节 电离平衡获奖课件ppt,文件包含高中化学新教材同步选择性必修第1册第15讲电离平衡二电离平衡常数PPT课件+pptx、高中化学新教材同步选择性必修第1册第15讲电离平衡二电离平衡常数教师版docx、高中化学新教材同步选择性必修第1册第15讲电离平衡二电离平衡常数学生版docx等3份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
高中化学第一单元 弱电解质的电离平衡图片ppt课件: 这是一份高中化学第一单元 弱电解质的电离平衡图片ppt课件,共60页。PPT课件主要包含了NO1,NO2,NO3,点击右图进入等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一节 电离平衡教课ppt课件: 这是一份人教版 (2019)选择性必修1第一节 电离平衡教课ppt课件,共57页。PPT课件主要包含了第一节电离平衡,要点三电离平衡常数,电离常数,相对强弱,第一步等内容,欢迎下载使用。













