




人教版 (2019)选择性必修1第一节 电离平衡优秀课件ppt
展开小孩大哭过后,容易出现抽抽搭搭,停不下来、喘不上气,或者手脚僵硬的情况。
已知人体血液中存在如下平衡:
人体血液的pH需维持在7.35~7.45。当pH<7.35会导致酸中毒,pH大于7.45会导致碱中毒。
小孩大哭后出现的生理症状,与上述平衡相关,是随着哭泣,呼出大量CO2,平衡状态改变后,发生了轻微碱中毒。
出现轻微碱中毒后,如何缓解中毒症状呢?
需要控制条件,使上述平衡正向移动
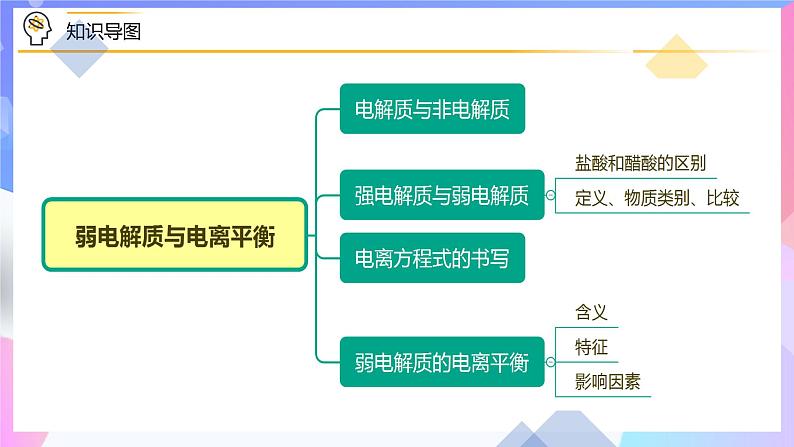
模块三 电离平衡常数
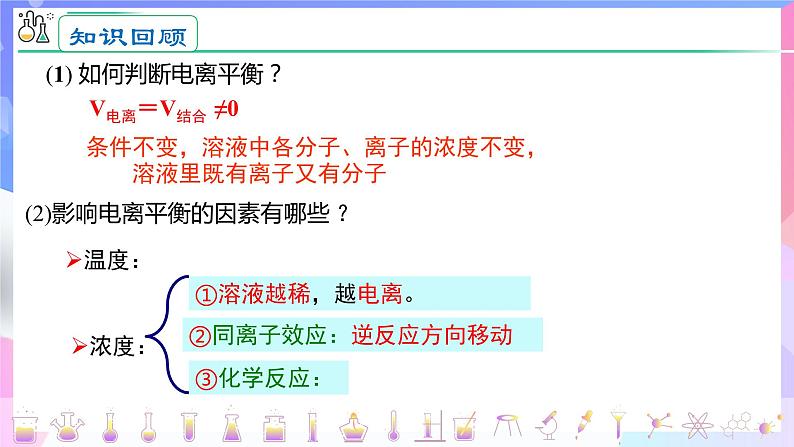
(1) 如何判断电离平衡?
(2)影响电离平衡的因素有哪些 ?
2. K值相对大小与弱酸的相对强弱有何关系 ?3. 以H2CO3为例,为什么多元弱酸Ka1≫Ka2呢?
条件不变,溶液中各分子、离子的浓度不变, 溶液里既有离子又有分子
V电离=V结合 ≠0
②同离子效应:逆反应方向移动
题型三:书写电离常数表达式
【练习1】写出醋酸的电离方程式,并写出该电离方程式的平衡常数表达式。
这个常数叫做电离平衡常数,简称电离常数。
对一元弱酸或者一元弱碱来说,在一定条件下,弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是个常数,这个常数称为电离平衡常数,简称电离常数。
【思考1】K值相对大小与弱酸的相对强弱有何关系?
某些弱电解质的电离常数(25℃)
【提示】在同一温度下,不同弱电解质的电离常数不同,说明电离常数首先由物质的本性所决定。对于同一弱电解质的稀溶液来说,K值只与温度有关。例如: 25℃时Ka(醋酸)=1.75×10-5, 0 ℃时Ka(醋酸)=1.65×10-5
【思考2】影响K值大小的因素有哪些?
H2CO3是二元弱酸,其电离方程式和电离常数分别为:
【思考3】以H2CO3为例,为什么多元弱酸Ka1≫Ka2呢?
H2CO3的一级电离,是从中性的H2CO3分子中电离出一个带正电的氢离子;H2CO3的二级电离,是从带负电的HCO3-中电离出一个带正电的氢离子;所以Ka1≫Ka2
【提示】①同一弱电解质,K值只与温度有关。②K值越大,电离程度越大,用K值大小判断弱电解质的相对强弱。③多元弱酸或多元弱碱分步电离,Ka1≫Ka2,计算多元弱酸溶液的c(H+)通常只考虑第一步电离。④⑤
【提示】①同一弱电解质,K值只与温度有关,与浓度无关。②电离过程需要吸热,温度越高K值越大, 电离程度越大③相同温度下,K↑,电离度↑,电离越完全;相同浓度,对应的酸(或碱)的酸(或碱)性越强;④多元弱酸或多元弱碱分步电离,Ka1≫Ka2,计算多元弱酸溶液的c(H+)通常只考虑第一步电离。⑤⑥
【练习2】写出醋酸、NH3·H2O的电离方程式,并写出该电离方程式的平衡常数表达式。
注意:通常用Ka、Kb分别表示弱酸、弱碱的电离常数。
【练习3】请写出Na2SO4、HClO、NH3·H2O 、H2CO3、Fe(OH)3在水溶液中的电离方程式,同时写出电离平衡常数表达式。
Na2SO4 = 2Na+ +SO42-
进一步计算该温度下,有多少比例的NH3·H2O发生了电离:
【例】在某温度时,溶质的物质的量浓度为 0.2 ml·L−1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10−3 ml·L−1
题型四:电离平衡常数综合
【例1】在某温度时,溶质的物质的量浓度为0.2ml·L-1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10-3 ml·L-1,试计算该温度下NH3·H2O的电离常数(Kb)。
【解】NH3·H2O的电离方程式及有关粒子的浓度如下:
起始浓度/(ml·L-1 )
变化浓度/(ml·L-1 )
平衡浓度/(ml·L-1 )
0.2-1.7×10-3
c(NH3·H2O)=(0.2-1.7×10-3)ml·L-1≈0.2ml·L-1
【答】该温度下NH3·H2O的电离常数约为1.4×10-5。
(2)若醋酸的起始浓度为0.010ml/L,平衡时氢离子浓度c(H+)是 . (提示:醋酸的电离常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.010ml/L。)
(1)当向该溶液中加入一定量的盐酸时,上式中的数值 (填增大、减小、不变),理由是 。
【例2】已知25℃下,醋酸溶液中存在下述关系: c(H+)·c(CH3COO-)/c(CH3COOH)=1.75×10-5 其中的数值是该温度下醋酸的电离平衡常数。 试回答下述问题:
温度不变,弱电解质的电离平衡常数不变
4.18×10-4ml/L
【例2】已知25℃下,醋酸溶液中存在下述关系: c(H+)·c(CH3COO-)/c(CH3COOH)=1.75×10-5
【解析】(2)设电离平衡时H+物质的量浓度为x
因醋酸的电离程度很小,故0.010-x≈0.010
即 x2/0.010=1.75×10-5 x=4.18×10-4ml/L
【例3】在25℃时,0.1ml/L的HNO2、HCOOH、HCN、H2CO3的溶液,它们的电离平衡常数分别为4.6×10-4、1.8×10-4、4.9×10-10、K1=4.3×10-7和K2=5.6×10-11,其中氢离子浓度最小的是( )A.HNO2 B.HCOOH C.HCN D.H2CO3
【解析】电离平衡常数大小可以判断弱酸(或弱碱)的相对强弱,K(多元弱酸则比较K1)越小,其电离程度越小,c(H+)越小,题中4.9×10-10 最小,则HCN酸性最弱, c(H+)最小。【答案】C
【实验3—2】你能否设计实验验证CH3COOH、H2CO3两种弱酸的相对强弱,由此推断Ka(CH3COOH)与Ka1(H2CO3)及其与电离常数大小的关系?
电离平衡常数:Ka(醋酸)=1.75×10-5 Ka1(碳酸)=4.5×10-7 Ka(醋酸)>Ka1(碳酸)
酸性: CH3COOH>H2CO3
【例1】(2021·全国高二)下表是几种弱酸在常温下的电离平街常数:
题型一:电离平衡常数的意义
则下列说法中不正确的是A.碳酸的酸性强于氢硫酸B.多元弱酸的酸性主要由第一步电离决定C.常温下,加水稀释醋酸, 增大D.向弱酸溶液中加少量NaOH溶液,电离平衡常数不变
题型二:根据电离常数书写方程式
【例2】(2021·全国高二专题练习)根据表中提供的数据,
判断下列离子方程式或化学方程式书写正确的是A.向Na2CO3溶液中滴加少量氯水:CO +2Cl2+H2O=2Cl-+2HClO+CO2↑B.向NaHCO3溶液中滴加少量氯水:2HCO +Cl2=Cl-+ClO-+2CO2↑+H2OC.向NaClO溶液中通入少量CO2:CO2+NaClO+H2O=NaHCO3+HClOD.向NaClO溶液中通入过量CO2:CO2+2NaClO+H2O=Na2CO3+2HClO
【例4】(2020·张家口市第一中学高二月考)已知25 ℃时,电离平衡常数,
回答下列问题:(1)下列四种物质电离出质子的能力由大到小的顺序是________(填标号)。a.HCO3- b.HClO c.CH3COOH d.H2CO3(2)下列反应不能发生的是___________。
(3)用蒸馏水稀释0.10 ml·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的______。
【答案】(1)c>d>b>a(2)CD (3)B
高中化学人教版 (2019)选择性必修1第一节 电离平衡背景图ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡背景图ppt课件,共17页。
高中化学人教版 (2019)必修 第一册第一节 铁及其化合物优秀ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第一节 铁及其化合物优秀ppt课件,共28页。PPT课件主要包含了学习目标,加水稀释促进电离等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡授课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡授课课件ppt,共23页。PPT课件主要包含了情境引入,表示方法,电离平衡常数,强弱电解质的比较,学以致用,随堂巩固等内容,欢迎下载使用。













