




- 专题14 沉淀的溶解平衡 (3)- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题15 沉淀的溶解平衡 (4)- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题02 电离平衡 (弱电解质的电离平衡- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 2 次下载
- 专题03 电离平衡 (电离平衡常数)- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题04 水的电离和溶液的pH- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
高中化学人教版 (2019)选择性必修1第一节 电离平衡评优课ppt课件
展开【复习回顾】一、电解质与非电解质
在水溶液中或熔融状态时能够导电的化合物。(包括酸、碱、盐、水、大多数金属氧化物)如:NaCl、HCl、CH3COOH 、MgO等
在水溶液中和熔融状态时都不能导电的化合物。(包括多数有机物、某些非金属氧化物)如: CH3CH2OH、CO2 、SO2等
电解质溶液的导电能力取决于溶液中自由移动离子浓度的大小以及离子所带电荷的多少。
下列物质中,属于电解质的是: , 属于非电解质的是: 。 ①NaCl溶液 ②NaOH ③H2SO4 ④Cu ⑤CH3COOH ⑥NH3 ⑦蔗糖 ⑧乙醇 ⑨水 ⑩ BaSO4
【注意】 (1)必须是化合物,单质和混合物既不是电解质也不是非电解质。例如:铜、氯化钠水溶液 (2)电解质不一定导电,导电的不一定是电解质。例如:氯化钠固体、氯化钠水溶液 (3)电解质必须是化合物本身能电离出离子,否则不属于电解质。例如:NH3、SO2、CO2
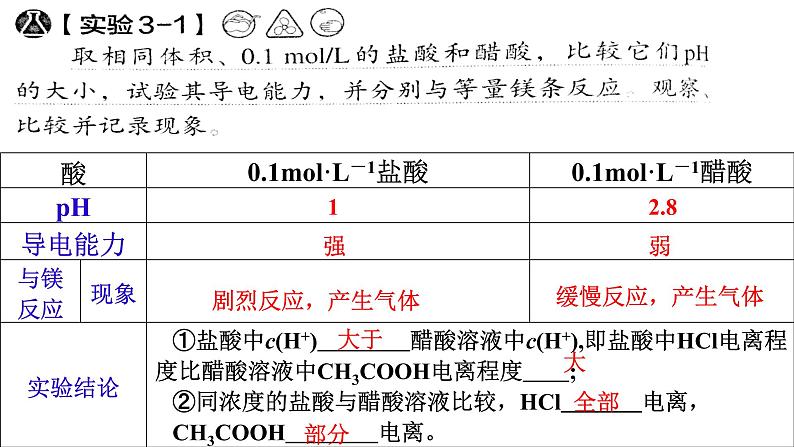
醋酸的腐蚀性比盐酸小,比较安全,为什么不用醋酸代替盐酸呢?
①盐酸中c(H+) 醋酸溶液中c(H+),即盐酸中HCl电离程度比醋酸溶液中CH3COOH电离程度 ; ②同浓度的盐酸与醋酸溶液比较,HCl 电离,CH3COOH 电离。
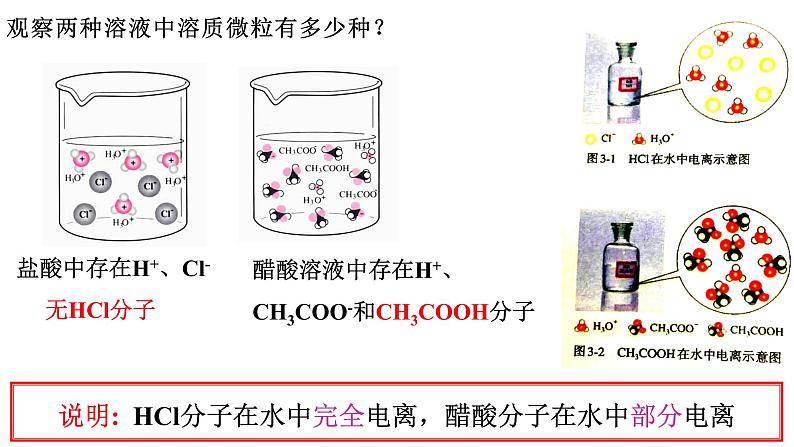
观察两种溶液中溶质微粒有多少种?
说明: HCl分子在水中完全电离,醋酸分子在水中部分电离
盐酸中存在H+、Cl- 无HCl分子
醋酸溶液中存在H+、CH3COO-和CH3COOH分子
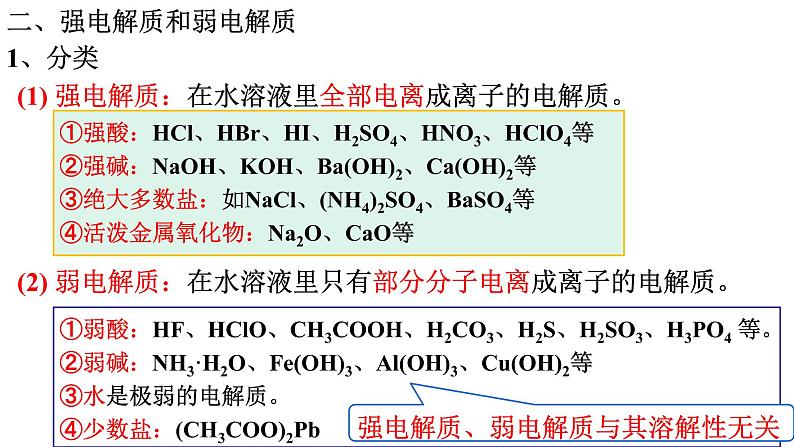
二、强电解质和弱电解质
(1) 强电解质:在水溶液里全部电离成离子的电解质。
(2) 弱电解质:在水溶液里只有部分分子电离成离子的电解质。
①强酸:HCl、HBr、HI、H2SO4、HNO3、HClO4等②强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等③绝大多数盐:如NaCl、(NH4)2SO4、BaSO4等 ④活泼金属氧化物:Na2O、CaO等
①弱酸:HF、HClO、CH3COOH、H2CO3、H2S、H2SO3、H3PO4 等。②弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等 ③水是极弱的电解质。④少数盐:(CH3COO)2Pb
强电解质、弱电解质与其溶解性无关
【思考1】氨水可导电,且呈弱碱性,氨水是否属于弱碱?
提示:氨水是氨气的水溶液,属于混合物,而碱属于化合物,所以氨水不属于弱碱。但氨水中的NH3·H2O属于弱碱。
(1)电解质的强弱是由物质的内部结构决定的;(2)电解质的强弱与化学键没有必然联系;(3)电解质的强弱与电解质的溶解性无关;(4)溶液导电能力与电解质的强弱没有必然联系。
理解强、弱电解质的注意事项
【思考2】讨论以下两种说法是否正确,并说明原因:①石墨、铜、铝合金都能导电,所以它们都是电解质。②离子化合物都是强电解质,而共价化合物都是弱电解质或非电解质。③CaCO3、Fe(OH)3的溶解度都很小,是弱电解质;CH3COOH、HNO3的溶解度都很大,是强电解质。④强电解质溶液的导电能力一定强于弱电解质溶液的导电能力。
1、下列物质能导电的是______,属于强电解质的是______,属于弱电解质的是_____,属于非电解质的是____。 a.铜丝 b.NaCl c.石墨 d.冰醋酸 e.HCl的水溶液 f.蔗糖 g.SO2 h.NaHCO3 i. BaSO4 j.氨水
2、(双选)把0.05ml NaOH固体分别加入下列100mL液体中,溶液的导电能力变化不大的是 ( ) A.自来水 盐酸 醋酸溶液 氯化铵溶液
【解析】B. HCl+NaOH=NaCl+H2O C. CH3COOH+NaOH=CH3COONa+H2O D. NH4Cl+NaOH=NaCl+NH3·H2O
3、向某氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是 ( )
2、电解质电离方程式的书写(1)强电解质 全部电离,只有离子,无分子,不可逆,在写电离方程式时,用“=”。如NaCl的电离方程式为:NaCl=Na++Cl-。(2)弱电解质 部分电离,既有分子又有离子,可逆,存在电离平衡,在写电离方程式时,用“ ”。 ①一元弱酸、弱碱一步电离:如CH3COOH: 。 NH3·H2O: 。
②多元弱酸是分步电离的(其中以第一步电离为主),电离程度逐步减弱,要分步书写电离方程式,不能一步完成。如H2CO3的电离方程式是
H2CO3 H++HCO3-(主要)
HCO3- H++CO32- (次要)
③多元弱碱的电离也是分步进行的,但是一般按一步电离的形式写。如Fe(OH)3的电离方程式: Fe(OH)3 Fe3++3OH-。
HCO3- H++CO32-
= Na++HCO3-
【规律】 强等号,弱可逆;多元弱酸分步写;多元弱碱一步完。
= Na++H+ +SO4-
第一步完全电离;酸根阴离子部分电离
4、请写出H2SO4、NH3·H2O、H3PO4、Al(OH)3 在水溶液中的电离方程式。
H2SO4 = 2H+ +SO42-
5.(1)(2014·全国卷Ⅰ改编)H3PO2是一元中强酸,写出其电离方程式: 。 (2)H2C2O4(草酸)是一种二元弱酸,写出其电离方程式: 。
6、在甲酸的下列性质中,可以证明它是弱电解质的是 。 A. 甲酸能与水以任意比例互溶 B. 1ml/L的甲酸溶液中c(H+)约为1×10-2 ml/L C. 醋酸溶液中存在醋酸分子 D.1ml/L的甲酸溶液10mL恰好与10mL1ml/L的NaOH溶液完全反应 E.醋酸能和碳酸钙反应放出CO2 F.大小相同的锌粒与相同物质的量浓度的盐酸和醋酸溶液反应,开始醋酸产生H2速率慢 G.在相同条件下,等浓度的甲酸溶液的导电性比盐酸弱
有酸性,物质的的量相等
人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素集体备课ppt课件: 这是一份人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素集体备课ppt课件,共16页。PPT课件主要包含了沉淀溶解平衡实验,沉淀溶解平衡图像,NaHCO3,46×10-6等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素课前预习ppt课件: 这是一份高中化学人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素课前预习ppt课件,共28页。PPT课件主要包含了沉淀的生成,1原则,3方法,同离子效应法,思考与交流,沉淀的溶解,1原理,2举例,+H+,迅速溶解等内容,欢迎下载使用。
2021学年实验活动1 探究影响化学平衡移动的因素图文课件ppt: 这是一份2021学年实验活动1 探究影响化学平衡移动的因素图文课件ppt,共12页。PPT课件主要包含了②溶度积规则,①离子积等内容,欢迎下载使用。













