








- 《实验活动1:探究影响化学平衡移动的因素》课件PPT+教学设计 课件 20 次下载
- 《电离平衡》第一课时课件PPT+教学设计 课件 29 次下载
- 《电离平衡》第三课时课件PPT+教学设计 课件 32 次下载
- 《水的电离和溶液的PH》第一课时课件PPT+教学设计 课件 31 次下载
- 《水的电离和溶液的PH》第二课时课件+教学设计 课件 22 次下载
《电离平衡》第二课时课件PPT+教学设计
展开(人教版高中化学选择性必修1)
《电离平衡》第二课时 教学设计
课题名 | 《电离平衡》第二课时 |
教材分析 | 本节教材是在学生学习了勒夏特列原理之后。溶液中的电离平衡也能用勒夏特列原理来解释,本节课要求学生认识弱电解质在水溶液中的电离过程,根据平衡移动原理理解温度、浓度等外在条件对弱电解质电离平衡的影响。 |
教学目标 | 宏观辨识与微观探析:认识弱电解质在水溶液中的电离过程,根据平衡移动原理理解温度、浓度等外在条件对弱电解质电离平衡的影响。 证据推理与模型认知:建立平衡移动模型,能用于解释溶液中的电离平衡。 科学探究与创新意识:能把平衡移动模型用于生活中现象的解释。 |
教学重点 | 认识弱电解质在水溶液中的电离过程,根据平衡移动原理理解温度、浓度等外在条件对弱电解质电离平衡的影响。 |
教学难点 | 认识弱电解质在水溶液中的电离过程,根据平衡移动原理理解温度、浓度等外在条件对弱电解质电离平衡的影响。 |
教学方法 | 讲解、举例 |
教学准备 | 教师准备:PPT 学生准备:预习课本 |
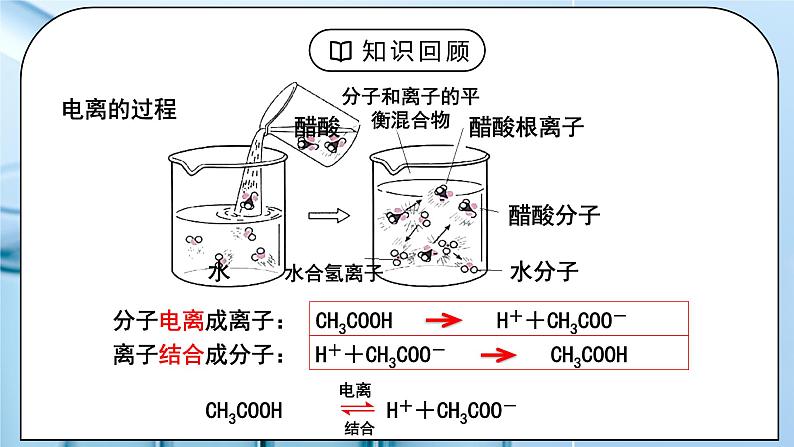
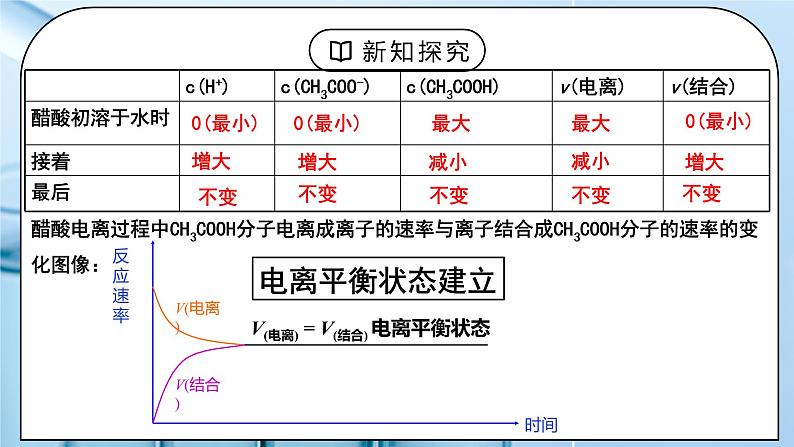
教学过程 | 一、新课导入 1.电离的过程 教师:CH3COOH H++CH3COO- 学生:思考回顾上节课内容电离的过程。 [设计意图]让学生思考回顾上节课内容电离的过程引入本节新课。 二、探究新知 1.二、弱电解质的电离平衡 教师:思考与讨论: ①开始时,V电离 和 V结合怎样变化? 弱电解质电离的V-t图像 ②当V电离 = V结合时,可逆过程达到一种什么样的状态? 画出V~t图。 醋酸电离过程中CH3COOH分子电离成离子的速率与离子结合成CH3COOH分子的速率的变化图像: 1.定义:在一定条件(如温度、浓度)下,当弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态 ——电离平衡 2.特征: 逆 弱电解质的电离 等 V电离=V分子化≠0 动 电离平衡是一种动态平衡 定 条件不变,溶液中各分子、离子 的浓度不变, 溶液里既有离子又有分子 变 条件改变时,电离平衡发生移动——平衡移动规律—勒夏特列原理 3、特点: ①电离(断键)过程是吸热的。 ②弱电解质的电离属于可逆过程,分子、离子共存,这完全不同于强电解质。 ③弱电解质在溶液中的电离程度都是微弱的。 电离方向是微粒数增多的过程.一般来说,实际参与电离的分子极少,绝大多数以分子形式存在,离子和分子之间存在电离平衡。 如0.1 mol·L-1的CH3COOH溶液中,c(H+)在1×10-3 mol·L-1左右。参与电离的分子数目是分子总数的百分之一左右(即相差两个数量级) 4、影响电离平衡因素: 电离平衡也是动态平衡,当外界条件改变时,电离平衡的移动满足勒夏特列原理 内因:弱电解质本身的性质,电解质越弱电离程度越小 外因: 温度:电离过程要断键吸热,温度升高,平衡向电离方向移动 浓度:溶液稀释平衡向电离方向移动,越稀越电离 其他因素: 同离子效应:加入与弱电解质具有相同离子的强电解质,抑制电离。 化学反应:加入能与弱电解质电离产生的某种离子反应的物质,可促进电离。 (1)浓度:对同一弱电解质,通常溶液中弱电解质的浓度越小,离子间通过碰撞结合成分子的机会越少(茫茫人海难再聚),电离程度越大。 ①加水稀释向电离的方向移动,电离程度增大(加水稀释相当于气相反应中的减压), 即:电解质溶液的浓度越小,它的电离程度就越大,但离子浓度减小; ②增加弱电解质浓度,向电离的方向移动,但电离程度减小(相当于气相反应中的加压) (2)温度的影响:电离(断键)过程吸热 讨论弱电解质的电离程度时,应当指出该弱电解质中溶质的浓度和温度。如不注明温度,通常指25 ℃。 (3)其他因素: ①同离子效应:0.1 mol/L CH3COOH溶液中 CH3COOH CH3COO- + H+ 加少量CH3COONa固体:电离平衡逆向移动。 c(CH3COOH)、c(CH3COO-)怎样变化?c(H+)? 同离子效应:在弱电解质溶液中,加入与弱电解质含有相同离子的易溶强电解质,抑制弱电解质电离,电离程度减小。 ②离子反应效应 0.1 mol/L CH3COOH溶液中 CH3COOH CH3COO- + H+ 加少量镁粉或NaOH:电离平衡正向移动。 c(CH3COOH)和c(H+)怎样变化?c(CH3COO-)? 离子反应效应:加入能与弱电解质电离产生的某种离子反应的物质时,减少了该离子的浓度,促进了弱电解质的电离, 使电离平衡向电离方向移动,电离程度增大。 学生:练习:一定温度下0.1mol/L稀醋酸溶液中存在平衡: CH3COOH CH3COO-+H+ ,其他条件相同时,试运用勒夏特列原理分析,改变下列条件,对表格中各项有什么影响? 练习1、弱电解质加水稀释时,电离程度_____,离子浓度______? (填变大、变小、不变或不能确定) 练习2、①有浓度相同、体积相等的三种酸: a、盐酸 b、硫酸 c、醋酸,同时加入足量的锌,则开始反应时速率______, 反应完全后生成H2的质量_________。(用<、=、> 表示) ②有H+浓度相同、体积相等的三种酸: a、盐酸 b、硫酸 c、醋酸,同时加入足量的锌,则开始反应时速率______,反应完全后生成H2的质量_________。 (用<、=、> 表示) 练习3、向两个锥形瓶中各加入0.05 g镁条,盖紧橡胶塞,然后用注射器分别注入2 mL 2 mol/L盐酸、 2 mL 2 mol/L醋酸,测得锥形瓶内气体的压强随时间的变化如图所示。请回答下列问题: (1)两个反应的反应速率及其变化有什么特点? (2)反应结束后,两个锥形瓶内气体的压强基本相等,由此你能得出什么结论? 练习3、向两个锥形瓶中各加入0.05 g镁条,盖紧橡胶塞,然后用注射器分别注入2 mL 2 mol/L盐酸、 2 mL 2 mol/L醋酸,测得锥形瓶内气体的压强随时间的变化如图所示。请回答下列问题: (1)两个反应的反应速率及其变化有什么特点? (2)反应结束后,两个锥形瓶内气体的压强基本相等,由此你能得出什么结论? 练习4、化合物HIn在水溶液中存在以下电离平衡,故可作酸碱指示剂HIn(aq) ⇌ H+(aq)+In-(aq) (红色) (黄色) 现把下列物质溶于水配成0.02 mol·L-1的水溶液,其中能使指示剂显黄色的是( ) ①HCl ②SO2 ③NaCl ④NaHSO4 ⑤氨气 ⑥Na2O2 ⑦Na2CO3 A.①②④ B.①④ C.⑤⑥⑦ D.⑤⑦ 练习5、在0.1mol•L-1CH3COOH溶液中存在如下电离平衡: CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是( ) A.加入少量CH3COONa固体,平衡正向移动,溶液的pH减小 B.加入少量NaOH固体,并恢复到室温,电离平衡常数增大 C.加入少量0.1mol•L-1HCl溶液,溶液中c(H+)减小 D.加热时,CH3COOH的电离平衡常数增大 [设计意图]掌握浓度,温度改变对电离平衡的影响。 |
板书设计 | 二、弱电解质的电离平衡
2.特征:逆、等、动、定、变 3、特点:吸热、可逆过程、程度微弱 4、影响因素: 内因: 外因:温度、浓度 其他因素:同离子效应、化学反应 |
课后作业 |
练习册上相关习题 |
教学反思 | 亮点:从内因外因以及其他因素分析了影响电离平衡的因素,重点分析讲解了温度,浓度对电离平衡的影响。 课堂教学建议:本节课内容较抽象,教师应举例分析温度,浓度对电离平衡的影响。 |











