




初中化学课题 1 质量守恒定律示范课ppt课件
展开1、“春蚕到死丝方尽,蜡炬成灰泪始干”,为什么蜡烛燃烧后什么也没有留下呢?2、废品收购站的经营之道是把废弃的钢铁收来堆放在潮湿的环境中等生满了锈才出售,为什么呢?
化学反应中反应前各反应物的质量总和与反应后各生成物的质量总和之间有什么关系呢?
生成物的质量总和 反应物的质量总和
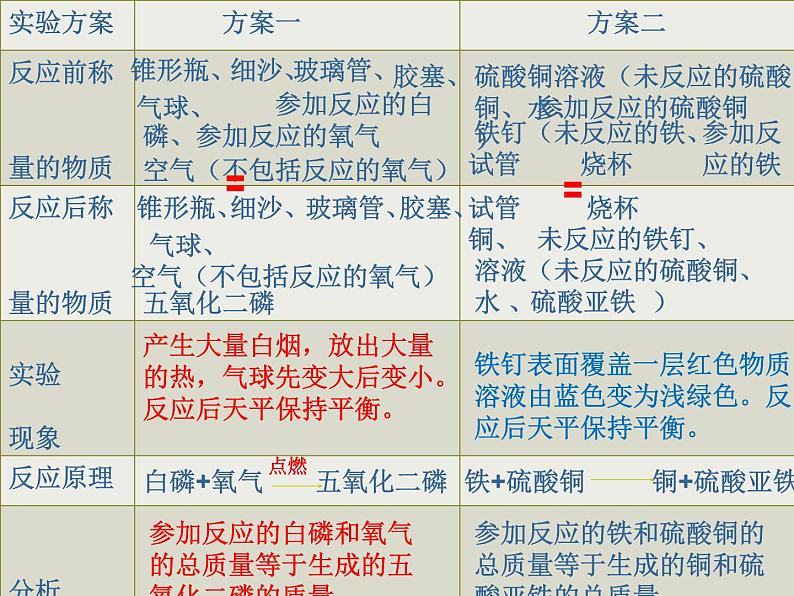
方案一:白磷燃烧前后质量的测定
方案二:铁与硫酸铜溶液反应前后质量的测定
(1)在锥形瓶中放一小堆干燥的白磷,(2)称量锥形瓶(含细沙、橡胶塞、玻璃管及小气球)和物质的总质量,(3)在酒精灯上加热玻璃管至红热状态,再点燃白磷,观察产生 的现象, (4)冷却后称量锥形瓶(含细沙、橡胶塞、玻璃管及小气球)和物质的总质量。
(1)在锥形瓶中加入适量硫酸铜溶液,塞好橡皮塞,(2)将几根用砂纸打磨干净的铁钉和锥形瓶一起称量总质量,(3)将铁钉浸到硫酸铜溶液中,一段时间后观察产生的现象,(4)再称量反应后的总质量。
产生大量白烟,放出大量的热,气球先变大后变小。反应后天平保持平衡。
参加反应的白磷和氧气的总质量等于生成的五氧化二磷的质量。
铁钉表面覆盖一层红色物质,溶液由蓝色变为浅绿色。反应后天平保持平衡。
参加反应的铁和硫酸铜的总质量等于生成的铜和硫酸亚铁的总质量。
白磷+氧气 五氧化二磷
铁+硫酸铜 铜+硫酸亚铁
空气(不包括反应的氧气)
铁钉(未反应的铁、 )
硫酸铜溶液(未反应的硫酸铜、水、 )
溶液(未反应的硫酸铜、水 、 )
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。(只适用于化学变化)
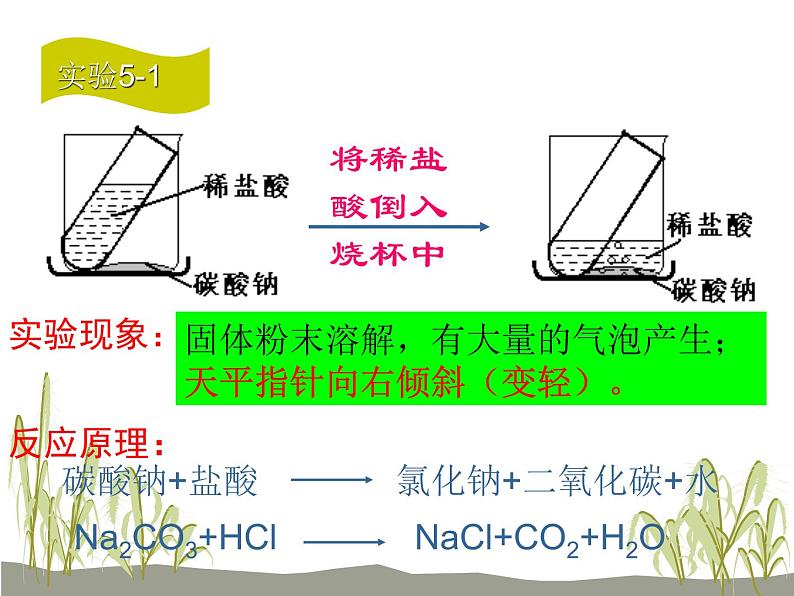
固体粉末溶解,有大量的气泡产生;天平指针向右倾斜(变轻)。
镁条燃烧前后质量的测定
1.称量长镁条和石棉网的总质量,2.再点燃镁条,观察现象,3.称量反应后的物质和石棉网的总质量。
讨论:1、实验5-1和实验5-2中第二次称量的结果与你的预计是否一致?为什么会出现这样的实验结果?2、这两个实验是否遵守质量守恒定律?
把握质量守恒定律应注意几点
1、只有化学变化才遵守质量守恒定律,物理变化不用质量守恒定律解释!2、守恒的是“总质量”,即“参加反应的各反应物的总质量”和“生成物的总质量”。 如气体也应考虑进去。若有气体参加或有气体生成的化学反应,要验证质量守恒定律应在密闭容器中进行。3、 “参加”,意味着没有参加反应(剩余)的物质的质量不能算在内。
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
为什么化学反应前后物质的质量总和相等?
请同学们用分子、原子的观点解释质量守恒的原因。
化学反应前后质量守恒的原因
(2)6克碳与一定量的氧气恰好完全反应,生成二氧化碳22克,有______克氧气参加了反应。
1、确定某反应物或生成物的质量。
2、推断反应物或生成物的组成元素。
酒精在氧气中燃烧生成二氧化碳和水,能否根据这一事实,推断出酒精中肯定会有什么元素?可能会有什么元素?
一定有的元素: 可能有的元素:
3、解释反应前后物质的质量变化。
纸在空气中燃烧后化为灰烬,灰烬的质量比纸的质量减小。 纸在空气中燃烧化为灰烬,纸中的碳元素与氧气反应生成二氧化碳气体散逸到空气中,故灰烬的质量比纸的质量小。
例1 在化学反应2X2 +3Y2 = 2R 中,若用X、Y表示R的化学式,其中正确的是( ) (A)X3Y2 (B)X2Y3 (C)X3Y4 (D)XY2
例2 铅丹 + 4HNO3 =PbO2 + 2Pb(NO3)2 + 2H2O , 根据化学方程式可推知铅丹的化学式为( )A. Pb B. PbO C. Pb2O3 D. Pb3O4
例3 在化学反应A +B = C 中,10克A物质恰好与8克B物质完全反应,则生成C物质的质量为 ( ) A、 8克 B、18克 C、10克 D、无法确定例4 将27.5克高锰酸钾加热,完全反应后剩余固体的质量为17.9克,则生成氧气的质量为 ( ) A、9.6克 B、12.6克 C、6.6克 D、14.9克
(化学反应前后物质的总质量守恒)
复习提问
1.小测验:用符号表达式表示下列化学反应。 (1)木炭在氧气中燃烧 (2)红磷在氧气中燃烧 (3)电解水 (4)过氧化氢分解 (5)氯酸钾和二氧化锰共热制氧气 (6)加热高锰酸钾 2.口答什么是质量守恒定律?用分子、原子的知识解释质量守恒的原因。
二、化学方程式
1、定义:用化学式来表示化学反应的式子,叫做化学方程式。 2、意义: (1)表示反应物、生成物和反应条件。(质) (2)表示反应物与生成物间的质量比(各物质的相对分子质量与化学计量数的乘积比)。 (量) (3)表示反应物、生成物之间的粒子个数比(各物质的化学计量数比)。 (微观)
九年级上册课题 1 质量守恒定律教案配套课件ppt: 这是一份九年级上册课题 1 质量守恒定律教案配套课件ppt,共21页。PPT课件主要包含了是巧合吗,验证实验一红磷燃烧,关键词化学反应,气球先变大后变瘪,天平平衡,缓冲气压,防止炸裂锥形瓶,容易引燃,关键词参加,实验注意事项等内容,欢迎下载使用。
人教版九年级上册第五单元 化学方程式课题 1 质量守恒定律课文配套课件ppt: 这是一份人教版九年级上册第五单元 化学方程式课题 1 质量守恒定律课文配套课件ppt,共31页。PPT课件主要包含了实验2小结,化学反应前后,方案三,碳酸钠+盐酸→,氯化钠+水+二氧化碳,氢氧化钙+二氧化碳→,碳酸钙+水,铁丝燃烧,木材的燃烧,推断物质的化学式等内容,欢迎下载使用。
人教版九年级上册第五单元 化学方程式课题 1 质量守恒定律图文ppt课件: 这是一份人教版九年级上册第五单元 化学方程式课题 1 质量守恒定律图文ppt课件,共24页。PPT课件主要包含了知识回顾,完成下列化学反应,我们的实验,探究实验,质量为什么守恒,化学反应的实质,科学家的实验等内容,欢迎下载使用。













