






高中化学人教版 (2019)必修 第一册第三节 氧化还原反应评优课ppt课件
展开【考纲要求】1.认识有化合价变化的反应是氧化还原反应;2.了解氧化还原反应反应的本质是发生电子 的转移。3.熟悉常见元素的化合价,能根据化学式 判断元素的化合价。
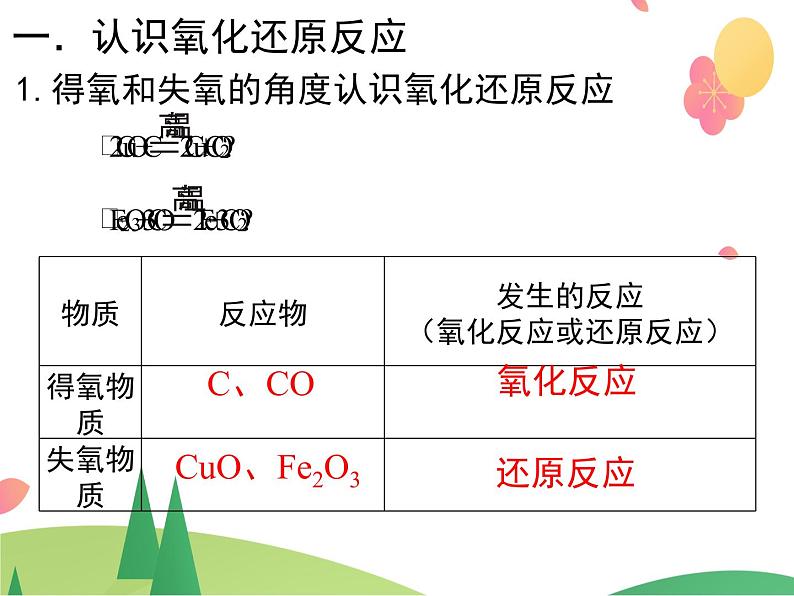
1.得氧和失氧的角度认识氧化还原反应
在化学反应中,一种物质得到氧发生氧化反应, 必然有一种物质失去氧发生还原反应。也就是说氧化反应和还原反应是在 中同时发生的,这样的反应称为 。
2.从化合价的变化认识氧化还原反应
(1)请标出上述两个反应中各物质所含元素的化合价,比较反应前后化合价有无变化。
+2 0 0 +4
+3 +2 0 +4
【讨论】在上述反应中,物质发生氧化反应或还原反应,与物质所含元素的化合价升高或降低有什么关系?
反应①中,C得氧发生氧化反应,所含元素C化合价升高 ;CuO失氧发生还原反应,所含元素Cu化合价降低 。
反应②中,CO得氧发生氧化反应,所含元素C化合价升高 ;Fe2O3失氧发生还原反应,所含元素Fe化合价降低 。
【总结】反应①和②都有元素的化合价在反应前后发生变化。物质所含元素化合价升高, 发生的反应为氧化反应;物质所含元素化合价降低, 发生的反应为还原反应。
(2)请观察下面的反应,标注出发生化合价变化的元素。
0 +2 0 +2
在这个反应中,虽然没有物质得氧或失氧,但是反应前后却有化合价的变化:
Fe元素的化合价从0升高到+2,发生氧化反应;Cu元素的化合价从+2降低到0,发生还原反应。这样的反应也是氧化还原反应。
【例题】分析下面几个反应中反应前后元素化合价的变化情况:
①C 0 +4 氧化反应;Cu +2 0 还原反应②C 0 +2 氧化反应;H +1 0 还原反应
3.从电子转移的角度来认识氧化还原反应
反应前后有元素化合价变化,是氧化还原反应的重要特征。那么是什么原因导致元素化合价的变化呢?即氧化还原反应的本质是什么?
反应中发生了电子的得失,Na发生了氧化反应,Cl2发生了还原反应。
双方各以最外层1个电子组成一个共用电子对,使双方原子都达到稳定结构。由于氯原子对共用电子对的吸引能力比氢原子强,共用电子对偏向氯原子而偏离氢原子。
HCl中H显+1价,Cl显-1价
【结论】氧化还原反应中一定存在电子的转移,有的是电子得失,有的是共用电子对偏移。这是氧化还原反应的本质。元素的原子失去电子(或电子对偏离),则元素的化合价升高,物质被氧化,发生氧化反应;元素的原子得到电子(或电子对偏向),则元素的化合价降低,物质被还原,发生还原反应。
4.氧化还原反应的概念
氧化还原反应:有电子转移(得失或偏移)的反应是氧化还原反应。氧化反应:表现为被氧化的元素的化合价升高,实质是该元素的原子失去(或偏离)电子的过程;还原反应:表现为被氧化的元素的化合价降低,实质是该元素的原子得到(或偏向)电子的过程。
二.四种基本反应类型与氧化还原反应 的关系
(1)一定属于氧化还原反应的反应是置换反应。(2)一定不属于氧化还原反应的反应是复分解反应。(3)有单质参加的化合反应和有单质生成的分解反应,一定是氧化还原反应。
先标出熟悉元素的化合价,再根据化合物中元素化合价代数和为零的规则,求解其他元素的化合价。
强化记忆一价氢、氯、钾、钠、银;二价氧、钙、钡、镁、锌;三铝、四硅、五价磷;说变价也不难,二三铁、二四碳、二四六硫都齐全;铜汞二价最常见。
1.对氧化还原反应的认识过程可以归纳如下表:
2.氧化还原反应有下列两种关系:
①化合价升高⇒ 失电子⇒被氧化⇒发生氧化反应②化合价降低⇒ 得电子⇒被还原⇒发生还原反应
1.判断正误 A.有氧元素参加的反应一定是氧化还原反应 ( )B.分解反应一定是氧化还原反应 ( )C.有单质生成的反应一定是氧化还原反应 ( )D.在反应中不一定所有元素的化合价都发生了变化 ( )E.肯定有一种元素被氧化,就有另一种元素被还原 ( )F.某元素从化合态变成游离态时,该元素一定被还 ( )G.非金属单质在反应中只作氧化剂 ( )H.金属阳离子被还原不一定得到金属单质 ( )
【答案】× × × √ × × × √
2.下列变化属于氧化反应的是( ) A.H+ → H2OB.SO3 → H2SO4C.Fe3+ → Fe2+D.Cl— → Cl2 【答案】D
3.下列反应不属于氧化还原反应的是 ( )
4.下列生活中的一些变化或现象,发生了氧化还原反应的是 ( ) ①冶炼金属 ②由S制H2SO4 ③燃料的燃烧 ④铁生锈 ⑤盐酸洒在大理石地板上,有气泡产生 ⑥铁钉置与硫酸铜溶液中,表面出现一层铜 ⑦久置的石灰水出现“白膜” ⑧打开汽水瓶盖,有气泡冒出⑨氢气和氯气在光照的条件下爆炸生成氯化氢⑩制印刷电路板时常用氯化铁溶液作“腐蚀液”A.①③④⑥⑩ B.①②③⑥⑦⑧ C.④⑤⑦⑧⑨ D.①②③④⑥⑨⑩【答案】D
5.下列反应中,氧化反应和还原反应在同一元素中进行的是( )
6.标出下列化合物中画线元素的化合价KMnO4 HClO Na2O2 KClO3 Fe2O3 Na2CO3 NH4NO3 NaHSO4 H2SO3【答案】+7 +1 -1 +5 +3 +4 -3 +5 +6 +4
化学必修 第一册第三节 氧化还原反应教学课件ppt: 这是一份化学必修 第一册第三节 氧化还原反应教学课件ppt,共26页。PPT课件主要包含了生活中的氧化还原反应,学习目标,升失氧,降得还等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应课文内容课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应课文内容课件ppt,共23页。PPT课件主要包含了苹果“锈”了,铁锁锈了,铁矿石,氧化还原反应,化合价升高,化合价降低,电子的得失,失去电子,得到电子,失电子等内容,欢迎下载使用。
化学人教版 (2019)第三节 氧化还原反应优质课ppt课件: 这是一份化学人教版 (2019)第三节 氧化还原反应优质课ppt课件,共21页。PPT课件主要包含了用途广泛的铁,铁矿石等内容,欢迎下载使用。













