






必修 第一册专题3 从海水中获得的化学物质第一单元 氯气及氯的化合物精品ppt课件
展开1.能从化学反应中元素化合价的变化认识氧化剂和还原剂、氧化产物和还原产物等概念,熟知常见的氧化剂和还原剂,理清相关概念间的关系。促进“变化观念”化学核心素养的发展。2.认识物质的氧化性、还原性,学会分析预测物质具有的氧化性或还原性,建立判断物质氧化性、还原性强弱的“思维模型”。
什么是抗氧化剂、氧化剂、还原剂?
氧化剂:所含元素得到电子(或电子对偏向)的反应物。
还原剂:所含元素失去电子(或电子对偏离)的反应物。
①.氧化剂和还原剂均是指反应物质,是一种化学试剂,不是某一种元素。
②.氧化剂本身被还原,化合价降低,发生还原反应
③.还原剂本身被氧化,化合价升高,发生氧化反应
2Na+Cl2===2NaCl
氧化剂是_____,还原剂是_____;发生氧化反应的是_____,发生还原反应的是_____。
Fe
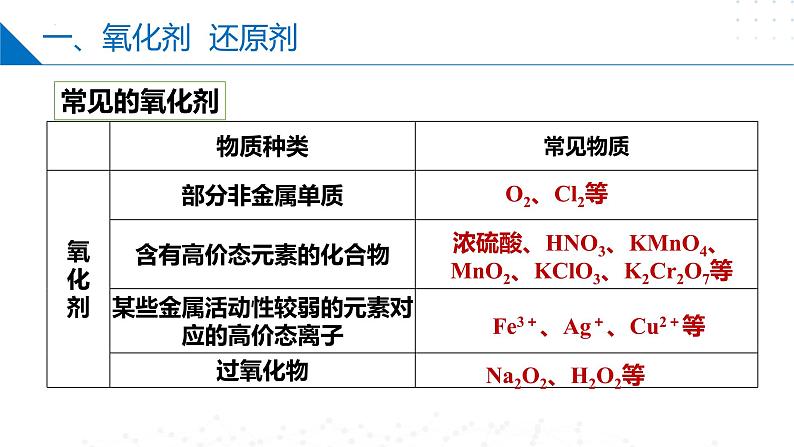
浓硫酸、HNO3、KMnO4、MnO2、KClO3、K2Cr2O7等
Fe3+、Ag+、Cu2+等
Na2O2、H2O2等
Cl-、Br-、I-、S2-、HI、NH3、H2S等
CO、SO2、H2SO3、Na2SO3、FeSO4等
以下反应的氧化剂和还原剂是什么?
Cl2 + H2O = HCl + HClO
在反应中,氧化剂和还原剂可以是同一物质
二、氧化产物 还原产物
氧化产物:还原剂失去电子被氧化的产物
还原产物:氧化剂得到电子被还原的产物
2HCl+Fe =FeCl2+H2↑
(元素化合价升高)生成物
(元素化合价降低)生成物
是氧化剂 是还原剂 被氧化 被还原 氧化产物 还原产物
氧化剂+还原剂=氧化产物+还原产物
化合价降低,得到电子,被还原,发生还原反应
化合价升高,失去电子,被氧化,发生氧化反应
降得还原氧化剂 升失氧化还原剂
以下反应的氧化产物和还原产物是什么?
在反应中,氧化产物和还原产物可以是同一物质
判断以下反应的氧化剂、还原剂、氧化产物和还原产物
2KMnO4 K2MnO4+MnO2+O2↑
反应中某些物质没有“身份”
反应中某些物质“身份”相同
例1. 歌词“帘外芭蕉惹骤雨,门环惹铜绿”,其中的“铜绿”即是铜锈,它的化学成分是Cu2(OH)2CO3(碱式碳酸铜)。铜在潮湿的空气中生锈的化学反应为2Cu+O2+CO2+H2O===Cu2(OH)2CO3。下列有关该反应的说法中不正确的是( )A.该反应是化合反应B.该反应中氧气是氧化剂,单质铜是还原剂C.该反应是氧化还原反应,只有两种元素的化合价发生了变化D.该反应是氧化还原反应,其中Cu得电子,O2失电子
氧化性:物质得电子的性质或能力
还原性:物质失电子的性质或能力
物质的氧化性及还原性与核心元素化合价的关系
还原性:还原剂 还原产物;氧化性:氧化剂 氧化产物。
(强氧化性) (强还原性) (弱还原性) (弱氧化性)
即“强制弱”或“前强后弱”
金属还原性:Fe Cu
Fe+CuSO4===FeSO4+Cu
(2)根据元素的活动性顺序比较
特点:上左下右可反应,隔之愈远愈易行。
例2.根据下列反应的离子方程式:①2Fe3++2I-===2Fe2++I2;②Br2+2Fe2+===2Br-+2Fe3+,可判断各物质的氧化性由强到弱的顺序是( )A.Fe3+、Br2、I2 B.Fe3+、I2、Br2C.Br2、Fe3+、I2 D.Br2、I2、Fe3+
氧化剂→_________→________→_________→__________→__________ ↑ ↑ ↑ ↑ ↑ ↑ 反应物—特征 — 本质 — 性质— 反应 — 生成物 ↓ ↓ ↓ ↓ ↓ ↓ 还原剂→_________→_________→_________→_________→________
四、氧化还原反应规律及应用
氧化还原反应中,原子得失电子总数相等,元素化合价升降总数相等,即有关系式:还原剂失电子的总数=氧化剂得电子的总数。元素化合价降低的总数=元素化合价升高的总数。应用:氧化还原反应方程式的配平,氧化还原反应的相关计算。
①标变价: 标出发生氧化还原反应的元素的化合价②列变化:(以选择的物质为基准) 找出它们化合价的改变量(电子得失数)③求总数: 求改变的化合价或得失电子数的最小公倍数④配计量数: 用观察法和质量守恒定律配平其余各物质的化学计量数⑤检查:质量守恒、电子得失守恒,单线改等号
【例】 C+ HNO3(浓)— NO2↑+ CO2 ↑ + H2O
0 +5 +4 +4
1 4 4 1 2
____Cu+____HNO3(稀)===____Cu(NO3)2+____NO↑+__H2O
____KI+____KIO3+____H2SO4===____I2+____K2SO4+____H2O
2、优先规律(反应顺序)
(1)当一种氧化剂遇到多种还原剂时,还原剂按还原性先强后弱的顺序参与反应。
将Cl2通入FeBr2溶液中,Cl2能氧化Fe2+、Br-,由于还原性Fe2+>Br-,所以Fe2+先被氧化,若反应后有Cl2剩余,Br-再被氧化。
把FeAl合金放入稀盐酸中,由于Al的还原性强于Fe,所以Al先反应,当Al反应完全后,Fe开始反应。
(2)同理,当一种还原剂遇到多种氧化剂时,氧化剂按氧化性先强后弱的顺序参与反应。
如Fe与CuCl2、HCl的混合溶液反应时,Fe先与Cu2+反应,后与H+反应。
氧化还原反应规律及应用
守恒规律优先规律(反应顺序)
氧化性 还原性强弱比较
苏教版 (2019)必修 第一册专题3 从海水中获得的化学物质第一单元 氯气及氯的化合物背景图课件ppt: 这是一份苏教版 (2019)必修 第一册<a href="/hx/tb_c4002498_t3/?tag_id=26" target="_blank">专题3 从海水中获得的化学物质第一单元 氯气及氯的化合物背景图课件ppt</a>,共33页。PPT课件主要包含了口诀氧价降,Cl2,MnO2,HCl,MnCl2,课堂小结等内容,欢迎下载使用。
高中人教版 (2019)第三节 氧化还原反应教学课件ppt: 这是一份高中人教版 (2019)第三节 氧化还原反应教学课件ppt,共22页。PPT课件主要包含了为什么,学习目标等内容,欢迎下载使用。
人教版 (2019)必修 第一册第三节 氧化还原反应评课ppt课件: 这是一份人教版 (2019)必修 第一册第三节 氧化还原反应评课ppt课件,共16页。PPT课件主要包含了教学目标,有电子转移的反应,失去电子的反应,得到电子的反应,元素化合价降低的反应,元素化合价升高的反应,氧化剂,还原剂,氧化产物,还原产物等内容,欢迎下载使用。













