




人教版 (新课标)选修5 有机化学基础第二节 醛优质ppt课件
展开1、能说出乙醛的物理性质和主要用途。2、掌握乙醛的结构特点和主要化学性质(学习重点)。初步掌握乙醛与银氨溶液、新制Cu(OH)2反应的化学方程式的正确书写(学习难点)。
【评价任务一】 写出乙醇在铜催化下加热反应的方程式?
╳ ╳
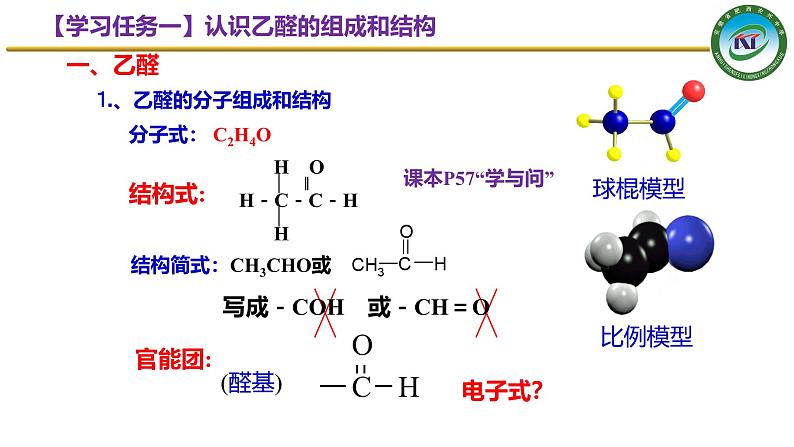
写成-COH 或-CH=O
结构简式:CH3CHO或
⒈、乙醛的分子组成和结构
H O ▏ ‖H-C-C-H ▏ H
【学习任务一】认识乙醛的组成和结构
乙醛是无色、有刺激性气味的液体,密度比水小,沸点是 20.8℃,易挥发,易燃烧,能和水、乙醇、乙醚、氯仿等互溶
【评价任务二】 乙醛、苯、CCl4均为无色液体,如何用最简便的方法鉴别?
用水,不分层的是乙醛,分层且水在下层的是苯,剩下的是CCl4。
【学习任务二】了解乙醛的物理性质
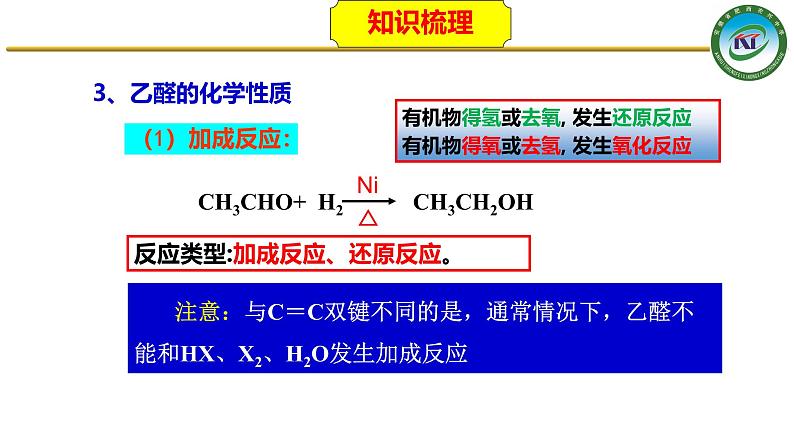
CH3CHO+H2 CH3CH2OH
断键形式:C=O的双键中的一个键打开
问题与讨论: 通过乙醇的催化氧化可以得到乙醛,那么乙醛能否被还原为乙醇呢?
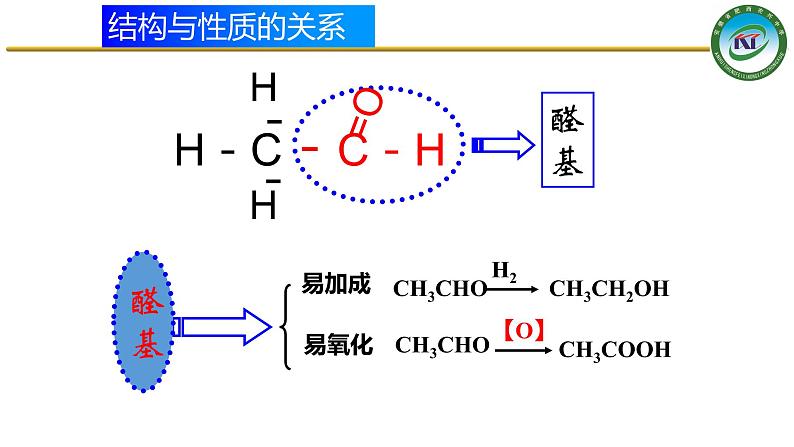
O CH3 C H
CH3 CH2 OH
【学习任务三】掌握乙醛的化学性质
CH3CHO+ H2 CH3CH2OH
有机物得氢或去氧, 发生还原反应有机物得氧或去氢, 发生氧化反应
注意:与C=C双键不同的是,通常情况下,乙醛不能和HX、X2、H2O发生加成反应
反应类型:加成反应、还原反应。
(醛基的C-H中加O成羧基)
燃烧 :2C2H4O+5O2 4CO2+4H2O
2CH3CHO+O2 2CH3COOH
课本P57“实验3-5”
取一洁净试管,加入2ml2%的AgNO3溶液,再逐滴滴入2%的稀氨水,至生成的沉淀恰好溶解。
氢氧化二氨合银-银氨溶液
现象:先生成白色沉淀,后沉淀恰好溶解。
Ag++NH3·H2O=AgOH ↓+ NH4+ AgOH+2 NH3·H2O=[Ag(NH3)2]++OH-+2H2O
在配好的上述银氨溶液中滴入三滴乙醛溶液,然后把试管放在热水浴中静置。
现象:试管内壁附着一层光亮如镜的金属银
CH3CHO+2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3+H2O
思考:1ml乙醛最多可以与多少Ag(NH3)2OH反应?生成多少Ag?
(1)试管内壁必须洁净;(2)须用新配制的银氨溶液,氨水不能过量.(防止生成易爆物质);(3)必须水浴加热,且不可振荡和摇动试管;(4)必须在强碱性溶液中进行(5)实验后,银镜用稀HNO3浸泡,再用水洗
巧记方程式:一水,二银,三氨,某酸铵
课本P57“实验3-6”
CH3CHO+2Cu(OH)2 + NaOH CH3COONa+Cu2O↓+3H2O
【注意】试剂滴加顺序:
向NaOH溶液中加入几滴CuSO4。
与新制Cu(OH)2反应
红色沉淀(Cu2O)
思考:1ml乙醛最多可以与多少Cu(OH)2反应?生成多少Cu2O?
银镜反应和Cu(OH)2反应的共同点?
1、均可用于鉴定-CHO的存在。2、均在碱性环境中进行。3、-CHO与Ag(NH3)2OH或 Cu(OH)2均以物质的量比1:2反应。
问题与交流:乙醛能否使酸性KMnO4溶液褪色?乙醛能否使溴水褪色,是发生了什么反应?
使酸性高锰酸钾褪色 、
1、做乙醛被新制氢氧化铜悬浊液氧化的实验时,下列各步操作中:①加入0.5 mL 乙醛溶液;②加入10%的氢氧化钠溶液2 mL;③加入2%的CuSO4溶液4~6滴;④加热试管。正确的顺序是 。2、实验室配制少量银氨溶液的方法是:先向试管中加入 ,然后 。其反应的离子方程式为 、 。 3、乙醛 (填“能”或“不能”)使高锰酸钾溶液或溴水褪色。洗涤做过银镜反应的试管,最好选用 试剂。
高中人教版 (新课标)第二节 醛评课课件ppt: 这是一份高中人教版 (新课标)第二节 醛评课课件ppt,共36页。PPT课件主要包含了学习目标,乙醛的物理性质,乙醛的组成和结构,醛基上的氢,甲基上的氢,学与问,乙醛的化学性质,葡萄糖的结构式,二氧化反应,1配制银氨溶液等内容,欢迎下载使用。
高中化学人教版 (新课标)选修5 有机化学基础第二节 醛示范课ppt课件: 这是一份高中化学人教版 (新课标)选修5 有机化学基础第二节 醛示范课ppt课件,共31页。PPT课件主要包含了生活中的醛你知道吗,新知导入,杏仁含苯甲醛,桂皮含肉桂醛,结构式,结构简式,CHO,醛基和醛,常见的醛,官能团醛基等内容,欢迎下载使用。
高中化学人教版 (新课标)选修5 有机化学基础第二节 醛图片ppt课件: 这是一份高中化学人教版 (新课标)选修5 有机化学基础第二节 醛图片ppt课件,共24页。PPT课件主要包含了成的化合物,子结构,CH2O,HCHO,物理性质,有刺激性,福尔马林,水和有机溶剂,C2H4O,CH3CHO等内容,欢迎下载使用。













